Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Работа 3. Определение набухаемости (ГОСТ 10898.4—84).Во взвешенный с точностью до 0,1 г цилиндр емкостью 250 мл с притертой пробкой насыпают 50—60 см3 ионита с известной влажностью, определяют его массу в воздушно-сухом состоянии по формуле: m=x1V где х— насыпная масса ионита; V— объем воздушно-сухого ионита. В цилиндр с ионитом наливают дистиллированную воду, несколько раз встряхивают, доливают до метки и оставляют для набухания на 24 ч. Измеряют объем набухшего ионита и вычисляют набухаемость (x3) по формуле:
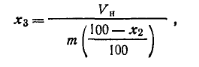
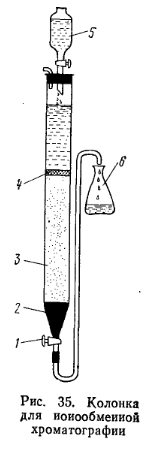
где x3 — объем набухшего ионита; т — масса ионита; х2— влажность. Работа 4. Очистка ионита от примесей и подготовка его к анализу (ГОСТ 10896—78).Порцию ионита 20—30 г с величиной зерен 0,2—0,3 мм помещают в делительную воронку, заливают 3-кратным объемом воды, встряхивают и оставляют на 24 ч. В процессе набухания возможно растрескивание зерен смолы и образование мелкой фракции, которую отмывают 5-кратным объемом воды. После набухания катионит заливают 2 н. раствором гидроксида натрия и оставляют на 48 ч. Раствор щелочи сливают и промывают смолу дистиллированной водой до нейтральной реакции промывной воды по фенолфталеину. Для перевода катионита в Н-форму, его заливают 4 н. раствором соляной кислоты, выдерживают 48 ч и продолжают отмывать ионы железа вначале 2 н., затем 0,2 н. раствором соляной кислоты до исчезновения розовой окраски в промывном растворе с роданидом аммония. Реакция на ионFе3+: 5 мл промывного раствора помещают в пробирку, прибавляют 1 мл 4 н. раствора роданида аммония. Отмытый от железа катионит продолжают отмывать водой от иона хлора. Реакция на ион хлора: 5 мл промывного раствора помещают в пробирку, прибавляют 1—2 капли азотной кислоты, разбавленной 1:1, и 1 мл 0,25%-ного раствора нитрата серебра.  Отмытый катионит в Н-форме отфильтровывают на воронке Бюхнера и подсушивают на воздухе до такого состояния, чтобы его зерна отделялись одно от другого. Подготовленный таким образом катионит хранят в банке с притертой пробкой. При подготовке к анализу сильноосновного анионита набухшую смолу заливают 2 н. раствором соляной кислоты на 48 ч, затем отмывают водой до удаления иона хлора (реакция на ион хлора с нитратом серебра). Чтобы перевести анионит в ОН-форму, его заливают 2 н. раствором гидроксида натрия также на 48 ч. Раствор щелочи сливают, промывают анионит водой до нейтральной реакции по фенолфталеину. Отмытый от щелочи сильноосновной анионит хранят под водой в банке с притертой пробкой. Слабоосновной анионит подготавливают по такой же методике, как и сильноосновной анионит, с той лишь разницей,что регенерацию ведут растворами карбоната натрия с постепенно увеличивающейся концентрацией (от 5 до 10 %) до исчезновения в фильтрате иона Сl- Затем отмывают дистиллированной водой до нейтральной реакции по фенолфталеину. Полученный анионит в ОН-форме отфильтровывают на воронке Бюхнера и подсушивают на воздухе. Работа 5. Проведение ионного обмена.Подготовка колонки. Колонкой для ионообменной хроматографии (рис. 35) может служить бюретка емкостью 50 мл со стеклянным краном, снабженная специальным устройством, которое автоматизирует вымывание анализируемых веществ и в то же время не позволяет жидкости опускаться ниже слоя ионита, тем самым предохраняет от попадания воздуха.
Укрепив колонку в штативе в вертикальном положении, закрывают кран 1, помещают над ним дренаж из стекловаты 2 и наполняют ее дистиллированной водой на 3/4 объема. Затем смывают в колонку подготовленный ионит и одновременно открывают кран. Чтобы между зернами ионита не остались пузырьки воздуха, через колонку снизу вверх пропускают струю воды. Когда слой ионита 3 достигает 18—20 см, кран закрывают и над слоем ионита помещают тампон из стекловаты 4, препятствующий его всплыванию. Над тампоном всегда должен быть слой жидкости не менее 1 см. Фильтрация анализируемого раствора. Перед началом определения проверяют реакцию воды, вытекающей из колонки. Если она отличается от нейтральной, колонку необходимо еще раз промыть водой. Затем через колонку пропускают анализируемый раствор из капельной воронки 5, поддерживая скорость вытекания жидкости из колонки 20—25 капель в 1 мин, и собирают вытекающую жидкость в коническую колбу 6. После этого с указанной скоростью промывают колонку водой до нейтральной реакции, собирая промывную воду в ту же колбу. Необходимо следить за уровнем жидкости в колонке, не допуская попадания воздуха в слой ионита. В фильтрате химическими и физико-химическими методами определяют содержание элементов, входящих в анализируемую смесь. Регенерация ионита. Через колонку с катионитом пропускают 4%-ный раствор кислоты, через колонку с анионитом — 5%-ный раствор карбоната натрия или щелочи до тех пор, пока концентрация отходящей кислоты или щелочи не станет равной исходной, после чего колонку промывают дистиллированной водой до нейтральной реакции по метиловому оранжевому или фенолфталеину. Колонку данного ионита можно использовать для 10—12 определений без регенерации.
6.4. ПОТЕНЦИОМЕТРИЧЕСКИЙ АНАЛИЗ
Потенциометрический метод анализа основан на измерении величины потенциала электрода, погруженного в исследуемый раствор, в зависимости от физических или физико-химических процессов в этом растворе. Природа электрода, концентрация и свойства раствора, в который опущен электрод, температура и другие факторы влияют на величину потенциала. По изменению разности потенциалов электродной пары, т. е. ее электродвижущей силы (ЭДС), можно проследить ход химических реакций и осуществлять контроль технологического режима производства. Потенциометрический метод анализа широко применяется для исследования полимерных соединений. В лабораторной практике различают потенциометрнческое титрование — определение эквивалентной точки не по изменению цвета индикатора, а по резкому изменению электродного потенциала и определение концентрации ионов в растворе.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 382. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |