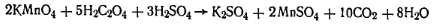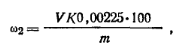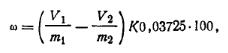Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
КАРБОНОВЫЕ КИСЛОТЫ, ИХ АНГИДРИДЫ И СЛОЖНЫЕ ЭФИРЫ
Карбоновые кислоты подразделяют на алифатические и ароматические, а каждую из этих групп — на одноосновные и многоосновные, насыщенные и ненасыщенные. В промышленности полимеров наибольшее значение имеют адипиновая, себациновая, акриловая, метакриловая кислоты и их эфиры, а также фталевый и малеиновый ангидриды. Из эфиров еще следует назвать винилацетат и диметиловый эфир терефталевой кислоты (диметилтерефталат). Общим методом количественного определения органических кислот является ацидиметрическое титрование. Для некоторых групп кислот, кроме того, существуют специфические методы, позволяющие определить их в смеси с другими кислотами. Для количественной характеристики смеси кислот, незначительно различающихся по физическим и химическим свойствам, применяют условный химический показатель — кислотное число. Кислотным числом (к. ч.) называют массу (мг) гидроксида калия, необходимую для нейтрализации свободных кислот, со-содержащихся в 1 г анализируемого вещества. Кислотное число обычно определяют для пофазного контроля смолы и сложных эфиров, оно часто служит характеристикой качества готовой продукции. Количественное определение сложных эфиров основано на реакции гидролитического расщепления (омыления). В результате омыления образуются спирт и соль кислоты:
По количеству щелочи, израсходованной на омыление, рассчитывают количество сложного эфира. Часто при анализе эфиров наряду с количественным их содержанием определяют другие химические показатели: кислотное число, число омыления, эфирное число, бромное число и др. Число омыления (ч. о.) соответствует массе (мг) гидроксида калия, необходимого для нейтрализации -свободных кислот и омыления эфиров, содержащихся в 1 г анализируемого вещества.  Реакция омыления протекает в присутствии щелочи. Скорость омыления зависит от концентрации ионов ОН~ в растворе и от температуры. Наиболее часто омыление проводят при температуре кипящей водяной бани. Сложные эфиры, плохо растворимые в воде, омыляют в спиртовой среде. Для омыления используют преимущественно раствор КОН. Спиртовые растворы щелочей при хранении меняют свой титр, поэтому поправочный коэффициент для них определяют в каждом отдельном случае с помощью контрольного титрования. Если в продукте требуется определить массовую долю только эфира, то титрование ведут ступенчато: сначала оттитровывают свободную кислоту, а затем производят омыление и по количеству щелочи, израсходованной на омыление нейтрализованного эфира, рассчитывают содержание его в исследуемом веществе. Эфирное число (э. ч.) соответствует массе (мг) гидроксида калия, необходимой для омыления сложных эфиров, содержащихся в 1 г исследуемого вещества. Эфирное число определяют как разность между числом омыления и кислотным числом. Бромное число (б. ч.) — масса (г) брома, который присоединяется к 100 г вещества. Для определения двойных связей в непредельных соединениях используют реакцию присоединения брома:
К испытуемому веществу приливают определенный объем раствора брома известной концентрации и по окончании реакции определяют остаток брома иодометрически по реакциям:
По массе брома, затраченной на бромирование, вычисляют массовую долю неопределенного соединения, выражаемую через бромное число. Так как чистый бром легколетуч, то для бромирования часто применяют бромид-броматный раствор (КВr + КВrО3).
Адипиновая кислота НООС— (СН2)4— СООН (Мr= 146,15)
Белый кристаллический порошок, хорошо растворим в спиртах, в воде практически не растворим. Основные требования к ее качеству приведены в табл. 4. Адипиновую кислоту применяют в производстве полиамидов, полиэфиров, полиуретанов, для синтеза пластификаторов и др.
Работа 1. Определение массовой доли свободной азотной кислоты. Азотную кислоту восстанавливают сплавом Девара до аммиака, который после прибавления к испытуемому раствору щелочи отгоняют в приемник, где он улавливается раствором титрованной кислоты. По массе связанной кислоты рассчитывают массовую долю азотной кислоты.
Ход определения. Навеску адипиновой кислоты ~10 г взвешивают в бюксе с точностью до 0,0002 г и переносят в круглодонную колбу емкостью 400 мл. Растворяют в 15 мл этилового спирта, вносят 10 г сплава Девара и 100 мл дистиллированной воды. Колбу 1 закрывают пробкой с вставленным в нее каплеуловителем 3, соединенным с холодильником 4 (рис. 45). В приемник 5 наливают 25 мл 0,1 соляной кислоты и 50 мл дистиллированной воды, добавляют несколько капель индикатора метилового красного и конец холодильника опускают в колбу 1.
Из воронки 2, вставленной в пробку круглодонной колбы, приливают 50 мл раствора гидроксида натрия (р=1,3). Перегонку ведут в течение 30 мин. Вследствие поглощения паров аммиака кислотой в колбе создается некоторое разряжение. Поэтому нельзя прекращать нагревание, прежде чем конец трубки холодильника не будет вынут из жидкости приемника. Иначе раствор может быть переброшен в перегонную колбу. Выделившийся аммиак поглощается раствором кислоты, находящимся в приемнике, с образованием аммонийной соли. Избыток кислоты оттитровывают 0,1 н. раствором гидроксида натрия. Одновремено ставят контрольный опыт. Молярная масса эквивалентна НNО3 равна массе моля. Массовую долю азотной кислоты ω1 (в %) рассчитывают по формуле где v1— объем 0,1 н. раствора гидроксида натрия, пошедший на титрование в контрольном опыте; V2— объем 0,1 н. раствора гидроксида натрия, затраченный на титрование в основном опыте; K — коэффициент поправки для 0,1 н. раствора гидроксида натрия; 0,0063— масса азотной кислоты, соответствующая 1 см3 точно 0,1 н. раствора гидроксида натрия, г; т — масса навески адипиновой кислоты.
Работа 2. Определение массовой доли щавелевой кислоты.Щавелевую кислоту определяют перманганатометрически в кислой среде:
Молярная масса эквивалента щавелевой кислоты равна 1/з массы ее моля, т. е. 45,0185 г. Реактивы и оборудование Серная кислота, р=1,84 Бюкс для взятия навески Перманганат калия, 0,05 н. раствор Колба коническая на 250 мл
Ход определения. Навеску адипиновой кислоты около 20 г переносят в коническую колбу емкостью 250 мл, добавляют 100 мл воды и 20 мл серной кислоты (1 :4). Нагревают до кипения и титруют 0,05 н. раствором перманганата калия до появления слабо-розового окрашивания. Массовую долю щавелевой кислоты ω2 (в %) вычисляют по формуле
где V— объем 0,05 н. раствора перманганата калия, затраченный на титрование; K — коэффициент поправки для 0,05 н. раствора перманганата калия;, 0,00225 — масса щавелевой кислоты, соответствующая 1 см3 точно 0,05 н. раствора перманганата калия, г; т — навеска адапиновой кислоты.
Белый кристаллический порошок с резким запахом, хорошо растворяется во многих органических растворителях, в воде растворим плохо. Применяют его в производстве ненасыщенных полиэфиров и сополимеров. Для контроля качества малеинового ангидрида (ГОСТ 11153—75) определяют массовую долю основного вещества (99,6%) и температуру кристаллизации (52,3°С). Малеиновый ангидрид раздражает слизистые оболочки глаз, верхних дыхательных путей и кожу, вдыхание его может вызвать отравление. Пораженные места следует обильно промыть водой, а затем слабым раствором соды. При измельчении малеинового ангидрида необходимо надевать защитные очки. Работа 3. Определение массовой доли малеинового ангидрида.В основе определения лежит реакция
Молярная масса эквивалента С4Н2О3 равна 49,029 г.
Реактивы и оборудование Гидроксид натрия, 1 н. раствор Бюкс для взятия навески Фенолфталеин, 1%-ный спиртовой Колба коническая на 250 мл раствор Ход определения. Навеску малеинового ангидрида ~ 1,5 г, взятую с точностью до 0,0002 г, помещают в коническую колбу емкостью 250 мл и растворяют в 50 мл воды, а затем титруют 1 н. раствором гидроксида натрия в присутствии фенолфталеина до слабо-розовой окраски. Массовую долю малеинового ангидрида ω (%) вычисляют по формуле где V— объем 1 н. раствора гидроксида натрия; K — коэффициент поправки для 1 н. раствора гидроксида натрия; т — навеска ангидрида; 0,049029—масса малеинового ангидрида, соответствующая 1 см3 точно 1 н. раствора гидроксида натрия, г.
Белые кристаллы в виде длинных игл, в воде не растворим, растворим во многих органических растворителях. Применяется в производстве полиэфирных смол и пластификаторов. Фталевый ангидрид раздражает кожу, слизистые оболочки глаз и верхних дыхательных путей. При попадании на кожу следует смыть водой с мылом. Для контроля качества фталевого ангидрида (ГОСТ 7119—77) определяют массовую долю основного вещества и температуру кристаллизации (табл. 5).
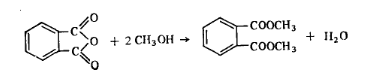
В зависимости от применяемого сырья фталевый ангидрид выпускают двух марок А и Б. Работа 4. Определение массовой доли фталевого ангидрида.Определение основано на реакции этерификации с образованием диметилового эфира фталевой кислоты:
Так как технический продукт содержит некоторое количество фталевой кислоты, то для определения истинного содержания фталевого ангидрида в испытуемом образце проводят два титрования. Титрованием до этерификации определяют объем раствора гидроксида натрия, израсходованного на фталевый ангидрид и фталевую кислоту, после этерификации — только на фталевую кислоту. Чтобы определить расход раствора гидроксида натрия на фталевый ангидрид, необходимо пересчитать объем титрованного раствора гидроксида натрия в обоих случаях на 1 г взятого для анализа вещества. Затем по разности величин определяют фактическую массовую долю фталевого ангидрида. Молярная масса эквивалента С8Н4О3 равна 1/2 массе его моля.
Ход определения. Берут две навески фталевого ангидрида, каждая величиной от 1 до 1,2 г. Одну навеску т1растворяют в 80 мл свежепрокипяченной воды, охлаждают без доступа СО2 и титруют 0,5 н. раствором гидроксида натрия в присутствии фенолфталеина (V1). Вторую навеску т2растворяют в 20 мл безводного метилового спирта, нагревают в течение часа при слабом кипении в конической колбе, соединенной с обратным холодильником. Затем охлаждают, разбавляют свежепрокипяченной водой до объема ~70 мл и титруют 0,5 н. раствором гидроксида натрия (У2) в присутствии фенолфталеина. Расход раствора гидроксида натрия в обоих определениях пересчитывают на 1 г взятого для анализа вещества. Для этого затраченный объем гидроксида натрия в обоих титрованиях V1и V2(мл) делят соответственно на взятые для каждого определения навески: v1/т1и V2/т2. Далее рассчитывают массовую долю фталевого ангидрида ω (в %):
где K — коэффициент поправки для 0,5 н. раствора гидроксида ратрия; 0,03725 — масса фталевого ангидрида, соответствующая 1 см3 точно 0,5 н. раствора гидроксида натрия, если реакция фталевого ангидрида проходит на 99,4%.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 632. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |