Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Определение рН потенциометрическим методом
Концентрация водородных ионов — весьма важный показатель в ряде технологических процессов. Концентрацию водородных ионов выражают водородным показателем рН, который представляет собой отрицательный логарифм активности водородных ионов: Буферными называют растворы, рН которых мало зависит от разбавления и от прибавления небольших количеств кислоты или основания. Для измерения рН применяют различные системы потенциометров и рН-метров, устройство которых позволяет прямо получать значение ЭДС или рН. В лабораторной практике широкое распространение получил рН-метр ЛПУ-01. Потенциометр ЛПУ-01с датчиком ДЛ-01 предназначен для определения активности ионов водорода в водных растворах. Прибор может быть также использован в качестве высокоомного милливольтметра или нуль-индикатора. Для регистрации показаний к прибору может быть подключен автоматический потенциометр типа ЭДП-,09. Элементы измерительной схемы прибора и электронный усилитель размещены в металлическом корпусе. Все управление прибором выведено на переднюю панель (рис. 40, а). В верхней части панели установлен показывающий прибор 6. Его шкала градуирована в единицах рН и милливольтах. Слева от показывающего прибора находится светофильтр 5 контрольной лампочки, сигнализирующей о том, что рН-метр включен. Включение прибора производится тумблером 7.  В средней части передней панели установлены переключатели 1, 2 и 3, предназначенные для включения рН-метра на требуемые пределы в зависимости от вида работы. Переключатель 2 предназначен для включения измерения в пределах - 200 ÷ +1400и +200 ÷ -1400 кВ. При измерении рН переключательставится в среднее положение. Пределы измерений рН устанавливаются переключателем 3. Переменные сопротивления 4 «Настройка по буферному раствору» и 8 «Крутизна» предназначены для настройки прибора по буферным растворам. Оси этих сопротивлений закрыты колпачками, предупреждающими случайное изменение настройки прибора при работе с ним. С левой стороны прибора (рис. 40, б) под откидной крышкой 13 помещены потенциометры 11 и 12, позволяющие изменять координаты изопотенциальнои точки, на которую настроен прибор. В приборе ЛПУ-01 предусмотрена возможность ручной и автоматической компенсации изменения характеристики электродной системы в зависимости от температуры контролируемого раствора. Ручная компенсация осуществляется переменным сопротивлением 9 (рис. 40, а) и винтом 10. На передней панели прибора нанесена шкала температур от 0 до 100°С с ценой деления 2°. Для автоматической температурной компенсации применяют специальный термокомпенсатор 17, который подключен к клеммам 15 и 16, расположенным на задней панели прибора (рис. 40, в).
Для ручной температурной компенсации клеммы 14 и 15 соединяют перемычкой 18. Клеммы 20 и 21 предназначены для подключения регистрирующего прибора, 19 — упор, 22— клемма для заземления, 23 — предохранитель, 24 — штекер. В качестве регистрирующего прибора могут быть использованы автоматические потенциометры ЭПП-09, ЭДП и др. Включение прибора. Вначале к потенциометру подключают датчик ДЛ-01 (рис. 41), вставив в гнездо прибора с надписью «Датчик» штекер, которым оканчивается кабель датчика. Провод заземления датчика присоединяют к клемме 1 «Земля» (см. рис. 40, а) на передней панели прибора. Для заземления корпуса прибора соединяют клемму 22 (см. рис. 40, в) на
задней стенке прибора, обозначенную знаком заземления, с линией заземления. Устанавливают механический нуль показывающего прибора, поворачивая отверткой корректор нуля и устанавливая стрелку на нулевую (начальную) отметку шкалы. Переключатели 2 «Виды работ» и 3 «Пределы измерений» (см. рис. 40, а) устанавливают в положение, соответствующее виду работы. Если измерения будут производиться с ручной температурной компенсацией, то проверяют наличие перемычки между клеммами 14 и 15 на задней панели прибора. При автоматической температурной компенсации перемычку с клеммы 15 снимают, а к клеммам 15 и 16 присоединяют выводы термокомпенсатора. Включают прибор в сеть на 220 В. Если напряжение сети 127 В, то используют бытовой повышающий трансформатор. Для включения прибора устанавливают тумблер 7 на передней панели в положение «Включено»; при этом загорается контрольная лампочка. При потенциометрических измерениях на приборе ЛПУ-01 с датчиком ДЛ-01 можно применять различные измерительные электроды, в том числе металлические. Отсчет показаний производят по нижней шкале показывающего прибора и умножают на 100. Измерительный электрод присоединяют к клемме «Изм» лабораторного датчика. В качестве вспомогательного электрода рекомендуется использовать хлорсеребряный электрод, который установлен в датчике.
ПОЛЯРОГРАФИЧЕСКИЙ АНАЛИЗ
Полярографический метод — один из электрохимических методов анализа, основанных на использовании процессов поляризации на ртутном или другом электроде, предложен чешским ученым Я. Гейровским (1922). В настоящее время этот метод применяется не только для проведения научно-исследовательских работ, но и для аналитического контроля различных производств, включая производство полимеров. В техническом анализе полимеров его применяют для анализа мономеров, для определения в полимерах остаточного мономера, примесей катализаторов, содержания пластификаторов, стабилизаторов; с его помощью можно изучать и контролировать процессы получения и деструкции полимеров. При полярографическом анализе определяют не количество продуктов реакции или затраченного реактива, а зависимость между концентрацией определяемого вещества, силой тока и напряжением в процессе электролиза. В испытуемый раствор опускают два электрода. Характерной особенностью является соотношение поверхностей применяемой пары электродов, близкое к 1 :100. Одним электродом служит ртуть, вытекающая в исследуемый раствор капельками с постоянной скоростью из очень тонкого отверстия стеклянной капиллярной трубки (капельный ртутный электрод), другим электродом— слой ртути с большой поверхностью на дне электролитического сосуда (макроэлектрод). Электроды соединяют с источником постоянного тока и постепенно повышают напряжение. При этом наблюдают за изменением силы тока / в зависимости от приложенного напряжения Е. Ввиду большой поверхности ртутный макроэлектрод не поляризуется (плотность тока обратно пропорциональна поверхности), и его потенциал остается в процессе электролиза постоянным. Поэтому по величине приложенного напряжения можно судить о потенциале только капельного ртутного микроэлектрода и, следовательно, о восстановительном или окислительном потенциале процесса, происходящего на микроэлектроде при данном значении приложенного напряжения. При наличии в исследуемом растворе веществ, способных восстанавливаться на капельном ртутном катоде (при подаче на него отрицательного заряда) или окисляться на капельном ртутном аноде (при подаче на него положительного заряда) в момент достижения для каждого вещества характерного потенциала, сила тока быстро возрастает. Сила тока фиксируется для каждого значения приложенного напряжения чувствительным зеркальным гальванометром. Графически эту зависимость выражают кривой с перегибами (волнами). На графике рис. 42, а по оси абсцисс отложено напряжение, а по оси ординат — значение соответствующей силы тока. По высоте и расположению на графике перегибов (волн) можно судить о составе и концентрации электролита. Полярографический метод позволяет установить присутствие определенных ионов (качественный анализ) и их концентрацию в растворе (количественный анализ). Качественный полярографический анализ основан на измерении напряжения, при котором наблюдается увеличение силы тока и электролитическое выделение того или другого иона. В качестве такого напряжения принимают потенциал полуволны Е1/2(рис. 42, а), при котором происходит возрастание силы тока до половины предельного значения. Следует отметить, что потенциал полуволны не зависит от концентрации деполяризатора, а зависит только от его природы. Количественный полярографический анализ основан на том, что по мере возрастания напряжения сила тока, проходящего через раствор анализируемого вещества, увеличивается, а кривая поднимается. По достижении некоторого значения силы тока выделение вещества идет очень быстро и не успевает компенсироваться за счет диффузии. Поэтому дальнейшее повышение напряжения не приводит к росту силы тока, и кривая образует характерный горизонтальный перегиб (см. рис. 42, а). Силу тока, соответствующую высоте lпр (высота волны), называют предельным током. Значение предельного тока пропорционально концентрации вещества в растворе. Для количественного полярографического анализа необходимо определить высоту волны (величину предельного тока lпр). Ее находят по графику (рис. 42, б). Проводят прямые 1, 2 и 3, затем в точках их пересечения проводят две параллельные друг другу и оси абсцисс прямые 4 и 5, расстояние между ними принимают за высоту волны (мм). В практике массового полярографического анализа концентрацию исследуемого вещества в растворе определяют методом, основанным на применении стандартных растворов с известной концентрацией определяемых ионов. Существует два сравнительных метода определения концентрации ионов: метод калибровочных (градуировочных) кривых и метод стандартных добавок. Метод калибровочных кривых. По этому методу сначала по-лярографируют несколько растворов исследуемого вещества с разными известными концентрациями и по полученным данным строят график, откладывая на оси абсцисс концентрацию, а на оси ординат — высоту волны. Затем в тех же условиях полярографируют анализируемый раствор, измеряют высоту волны и находят искомую концентрацию по калибровочной кривой.
Метод добавок.Сначала снимают полярографическую кривую для определенного объема испытуемой пробы с неизвестным содержанием определяемого вещества и измеряют высоту волны hх(мм). Затем к такому же объему пробы прибавляют определенный объем стандартного раствора анализируемого вещества. Вновь снимают полярографическую кривую и измеряют высоту волны hх+а. По разности высот волн вычисляют массовую долю и (в %) определяемого вещества в испытуемой пробе по формуле
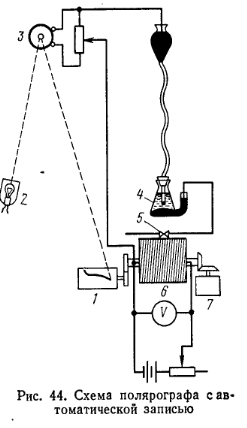
где а — масса вещества, содержащегося в добавленном стандартном растворе; hх— высота полярографической волны анализируемой пробы; hх+а — высота полярографической волны после добавки стандартного раствора; т — масса испытуемой пробы. Типы полярографов.Полярографическая установка предназначена для получения кривых зависимости силы тока, протекающего через полярографическую ячейку, от потенциала, приложенного к рабочему электроду. Ее собирают по компенсационной схеме (рис. 43), с помощью которой можно изменять напряжение, накладываемое на электролитическую ячейку 4. Передвижением контакта 2 по потенциометру 1 достигают потенциала выделения вещества в растворе, и сила тока резко возрастает, что отмечается гальванометром 3. В полярографическом анализе применяют визуальные полярографы, полярографы с автоматической фоторегистрацией и электронные полярографы.
В лабораторной практике чаще используют визуальный полярограф ПВ-5. На рис. 44 приведена схема прибора с автоматической фоторегистрацией. Во всех приборах этого типа полярограмма воспроизводится с помощью светового луча, направленного от зеркального гальванометра на щель цилиндрической фотокассеты..Потенциометр 6, представляющий собой барабан, на который намотана проволока, вращается электромотором 7 с определенной скоростью. При этом контакт 5 скользит вдоль витков калиброванной проволоки и подаваемая на ячейку 4 ЭДС плавно увеличивается. Лучи света от осветителя 2, отраженные зеркальцем гальванометра 3, направляются на щель фотокассеты, внутри которой вращается барабан 1. Барабан находится в зацеплении с потенциометром и вращается одновременно с ним. При каждом обороте барабана освещается щель и на фотобумаге вычерчивается соответствующая напряжению кривая. На одном и том же листе фотобумаги можно записать несколько полярограмм. Электронные полярографы обладают совершенной автоматикой, но устройство их значительно сложнее, чем устройство фоторегистрирующих приборов. Так, изменение силы тока фиксируется с помощью электронно-следящих систем и полярограмма вычерчивается пером самописца па специальной бумажной ленте. Нашей промышленностью выпускаются электронный автоматический полярограф ПА-3 и универсальный электронный полярограф УПЭ-6124.
ГЛАВА 7 АНАЛИЗ ОТДЕЛЬНЫХ ВИДОВ СЫРЬЯ В ПРОИЗВОДСТВЕ СИНТЕТИЧЕСКИХ СМОЛ И ПЛАСТИЧЕСКИХ МАСС
7.1.МНОГОАТОМНЫЕ СПИРТЫ
В промышленности пластмасс применяют такие многоатомные спирты, как гликоли, глицерин, пентаэритрит. Их используют в качестве мономеров при производстве полиэфирных и других смол. В заводской практике наиболее распространенные методы определения массовой доли многоатомных спиртов — рефрактометрический и на основе реакции окисления.
ЭтиленгликольС2Н4(ОН)2 (Мг=62,07)
Этиленгликоль представляет собой бесцветную сиропообразную жидкость, сладкую на вкус, без запаха. Смешивается с водой, ацетоном, низшими спиртами, глицерином; не смешивается с углеводородами, в частности с бензином. Ядовит. Работа 1. Определение массовой доли этиленгликоля окислением бихроматом калия в кислой среде. Метод основан на окислении этиленгликоля до диоксида углерода:
2С2Н4 (ОН)2 + 5К2Сг2O7 + 20Н2SO4→6СO2 + 5К25О4 + 5Сr2 (SО4)3+ 29Н2О
Бихромат калия (окислитель), взятый в избытке, реагирует с иодидом калия, выделяя иод, который оттитровывают тиосульфатом натрия:
К2Сг2О7+ 6КI+7Н2SО4 → 3I2+4К2SO4 +Сr2(SО4)3+7Н2О I2 + 2Nа2S2О3 → 2NaI +Nа2S4О6
Молярную массу эквивалента этиленгликоля рассчитывают, сопоставляяучаствующие в реакции вещества:
Реактивы и оборудование
Бихромат калия, раствор Колбы мерные на 250и 500 мл Колбы конические на 250 и 750 мл Цилиндры мерные на 50 мл. Воронки Пипетки на 25 и 50 мл Серная кислота, р=1,23 Иодид калия, 10%-ный раствор Тиосульфат натрия, 0,1 н. раствор Крахмал, 1%-ный раствор Бюкс для взятия навески
Приготовление раствора бихромата калия. 76 г бихромата калия переносят в литровую мерную колбу, растворяют в 250 мл воды, добавляют 150 мл серной кислоты (р = 1,84) и доводят водой до метки. Ход определения. Навеску этиленгликоля ~2 г, взятую с точностью 0,0002 г, переносят в мерную колбу емкостью 250 мл, растворяют в воде и добавляют до метки. Отбирают пипеткой 25 мл раствора и переносят в коническую колбу емкостью 250 мл, в которую затем вносят пипеткой 25 мл раствора бихромата калия и цилиндром 50 мл серной кислоты (р=1,23). Колбу со смесью накрывают небольшим опрокинутым стаканчиком и нагревают на кипящей водяной бане в течение 2 ч. После охлаждения содержимое колбы количественно переносят в мерную колбу емкостью 500 мл, доводят водой до метки и тщательно перемешивают. 50 мл этого раствора переносят пипеткой в коническую колбу емкостью 750 мл, добавляют цилиндром 20 мл 10%-ного раствора иодида калия и закрывают колбу пробкой. Через 5 мин смесь разбавляют водой до 500 мл и титруют 0,1 н. раствором тиосульфата натрия в присутствии раствора крахмала, который добавляют в конце титрования, когда окраска раствора примет соломенно-желтый цвет. Одновременно в тех же условиях проводят контрольный опыт, добавляя вместо исследуемого раствора гликоля 25 мл воды. Массовую долю этиленгликоля и (%) вычисляют по формуле
где V1— объем 0,1 н. раствора тиосульфата натрия, израсходованный на титрование в контрольном опыте; V2— объем 0,1 и. раствора тиосульфата натрия, израсходованный на основной опыт; К — поправочный коэффициент для 0,1 н. раствора тиосульфат натрия; т — масса навески этиленгликоля, г; 0,00062 — масса этиленгликоля, соответствующая 1 см3 точно 0,1 н. раствора тиосульфата натрия, г. Результат определения проверяют рефрактометрически (см. табл. 5 приложения). Глицерин С3Н5 (ОН)3 (Мг=92,09бЗ) Глицерин — бесцветная вязкая жидкость, сладкая на вкус, без запаха. Смешивается с водой и спиртом в любых соотношениях. Работа 2. Определение массовой доли глицерина окислением дихроматом калия в кислой среде. Метод основан на окислении глицерина до диоксида углерода
и относится к методу обратного титрования. Окислитель берут в избытке. Количество оставшегося бихромата калия определяют иодометрически:
Молярную массу эквивалента глицерина рассчитывают, сопоставляя участвующие в реакции вещества:
Метод дает точные результаты, только если в анализируемом продукте отсутствуют примесные вещества, способные окисляться (жирные кислоты). После нейтрализации раствора глицерина жирных кислоты осаждают раствором ацетата свинца.
Реактивы и оборудование Бихромат калияБюкс для взятия навески Серная кислота, р = 1,23Колбы мерные на 250 и 500 мл Иодид калия, 10%-иый растворПипетки на 25 мл Соляная кислота, 10%-ный раствор Колбы конические на 250 и 1000 мл Тиосульфат натрия, 0,1 н. раствор Цилиндр мерный на 50 мл Крахмал растворимый, 1%-ный раствор
Ход определения. Навеску глицерина ~2 г, взятую с точностью до 0,0002 г, переносят в мерную колбу емкостью 250 мл и разбавляют дистиллированной водой до метки. Отбирают пипеткой 25 мл раствора и переносят в коническую колбу емкостью 250 мл. Затем в колбу вносят пипеткой 25 мл раствора бихромата калия и цилиндром 50 мл серной кислоты р=1,23. Колбу со смесью накрывают небольшим опрокинутым стаканчиком и нагревают на кипящей водяной бане в течение 2 ч. После охлаждения содержимое колбы количественно переносят в мерную колбу емкостью 500 мл, доводят водой до метки и тщательно перемешивают. Полученный раствор (50 мл) переносят пипеткой в коническую литровую колбу, добавляют цилиндром 20 мл 10%-ного раствора иодида калия, 20 мл 10%-ной соляной кислоты и закрывают колбу пробкой. Через 3—5 мин раствор разбавляют дистиллированной водой до 500 мл и титруют 0,1 н. раствором тиосульфата натрия в присутствии раствора крахмала, который добавляют в конце титрования, когда окраска раствора примет соломенно-желтый цвет. Титрование ведут до светло-зеленой окраски. Одновременно в тех же условиях проводят контрольный опыт, добавляя вместо исследуемого раствора глицерина 25 мл воды. Массовую долю глицеринаω (%) вычисляют по формуле
где V1— объем 0,1 н. раствора тиосульфата натрия, израсходованный на титрование в контрольном опыте; V2— объем 0,1 н. раствора тиосульфата натрия, израсходованный на основной опыт; К — поправочный коэффициент для 0,1 н. раствора тиосульфата натрия; т — масса навески глицерина; 0,0006578 — масса глицерина, соответствующая 1 см3 точно 0,1 н. раствора тиосульфата натрия. Результат определения проверяют рефрактометрически (см.табл. 4 приложения).
АЛЬДЕГИДЫ
В промышленности пластмасс в качестве мономеров используют различные альдегиды (формальдегид, бензальдегид, масляный альдегид и др.). Для количественных определений альдегидов в заводской практике применяют сульфитный и гидроксил-аминовый методы, а также метод окисления.
Сульфитный метод основан на свойстве альдегидов образовывать с сульфитом натрия бисульфитное соединение с выделением гидроксида натрия:
Так как масса выделяющейся щелочи эквивалентна массовой доле альдегида, то ее рассчитывают по затраченному объему кислоты на титрование щелочи. Определение с помощью сульфита натрия относится к методу прямого титрования. Гидроксиламиновый метод основан на реакции альдегидов с солянокислым гидроксиламином NH2ОН ·НС1, в результате которой образуются альдоксимы:
Атом кислорода карбонильной группы обменивается на двухвалентный остаток =NOH, содержащий атом азота. Масса выделяющейся в реакции кислоты эквивалентна массовой доле альдегида, и, следовательно, ее можно рассчитать по затраченному объему щелочи. Метод окисления основан на взаимодействии альдегида с иодом в щелочной среде:
Поскольку эта реакция обратима, прибавляют гидроксид натрия для перевода НI и R—СООН в соли, не реагирующие друг с другом, но при этомNaОН реагирует и с иодом: I2 + 2NаОН → NaI + NaOI + H2O
Гипоиодид натрия окисляет альдегид:
После окисления альдегида прибавляют серную кислоту, для выделения иода из оставшегося гипоиодида натрия и из эквивалентного ему количества иодида натрия:
Выделившийся в свободном виде иод оттитровывают тиосульфатом натрия. Молярная масса эквивалента альдегида равна 1/2 массы его моля.
Формальдегид (муравьиный альдегид) СН2О (Мт= 30,03)
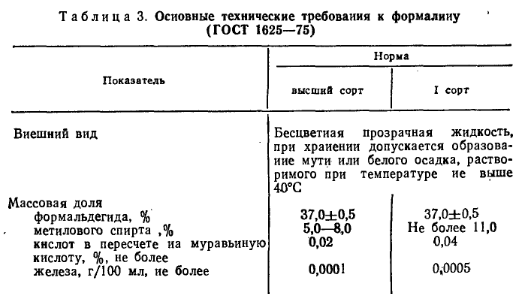
Формальдегид — бесцветный газ с резким характерным запахом. Температура кипения — 21°С, хорошо растворим в воде. В промышленности его получают каталитическим окислением метилового спирта или неполным окислением метана. Водные растворы формальдегида, известные под названием формалина, могут содержать до 55% формальдегида и различное количество метилового спирта. Формальдегид смешивается со спиртом в любых отношениях. При хранении формальдегид в формалине переходит в аморфный полимер формальдегида — параформальдегид Основные технические требования к формалину приведены в табл. 3.
В промышленности пластмасс формалин применяют в производстве фенолоформальдегидных,мочевино-формальдегидных смол и полиформальдегида.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 618. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
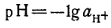 Значение рН характеризует кислотность или щелочность растворов. Для чистой воды при 22°С рН 7. Измерение рН потенциометрическим методом заключается в сравнении свойств индикаторного электрода в исследуемом растворе с его свойствами в стандартном растворе с известным рН. Для оценки рН на основании таких сравнительных измерений пользуются стандартным буферным раствором или шкалой таких растворов.
Значение рН характеризует кислотность или щелочность растворов. Для чистой воды при 22°С рН 7. Измерение рН потенциометрическим методом заключается в сравнении свойств индикаторного электрода в исследуемом растворе с его свойствами в стандартном растворе с известным рН. Для оценки рН на основании таких сравнительных измерений пользуются стандартным буферным раствором или шкалой таких растворов.





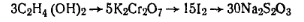










 В формалине всегда содержится примесь метилового спирта, который предохраняет формальдегид от перехода в параформальдегид, небольшие количества муравьиной кислоты и другие примеси.
В формалине всегда содержится примесь метилового спирта, который предохраняет формальдегид от перехода в параформальдегид, небольшие количества муравьиной кислоты и другие примеси.