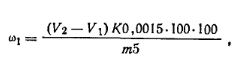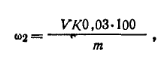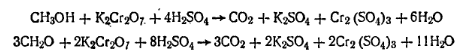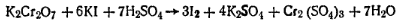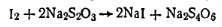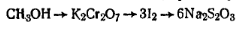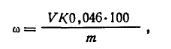Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Работа 1. Определение массовой доли формальдегида в формалине методом окисления.Реактивы и оборудование Иод, 0,1 н. растворБюкс для взятия навески Гидроксид натрия, 1 н. растворКолба мерная на 100 мл Соляная кислота, 1 н. растворПипетка на 5 н 20 мл Тиосульфат натрия, 0,1 н. растворКолба коническая с притертой проб- Крахмал растворимый, 1%-ный раст-кой на 250 мл вор?Мерный цнлнндр на 25 мл Ход определения. Навеску формалина ~ 1 г взвешивают в бюксе с точностью до 0,0002 г, переносят в мерную колбу емкостью 100 мл, доливают дистиллированной водой до метки и тщательно перемешивают. Из полученного раствора берут пипеткой 5 мл и помещают в коническую колбу емкостью 250 мл с притертой пробкой, туда же добавляют пипеткой 20 мл 0,1 н. раствора иода и по каплям вводят 1 н. раствор гидроксида натрия до появления желтой краски. Колбу закрывают, взбалтывают и оставляют стоять 10 мин. Затем содержимое колбы подкисляют 15 мл 1 н. раствора соляной кислоты и через 10 мин выделившийся иод оттитровывают 0,1 н. раствором тиосульфата натрия в присутствии крахмала в качестве индикатора. Параллельно ставят контрольный опыт. Массовую долю формальдегида ω1 (в %) рассчитывают по формуле
где V1— объем 0,1 н. раствора тиосульфата натрия, израсходованный на контрольный опыт; V2 — объем 0,1 н. раствора тиосульфата натрия, затраченный на титрование в основном опыте; К — коэффициент поправки для 0,1 г раствора тиосульфата натрия; т — масса навески формалина, г; 0,0015 — масса формальдегида, соответствующая 1 см3 точно 0,1 н. раствора тиосульфата натрия, г.
Работа 2. Определение формальдегида в формалине сульфитным методом. Нужно помнить, что растворы сульфита натрия при стоянии подвергаются гидролизу и имеют щелочную реакцию. Перед использованием их нейтрализуют кислотой. Нейтрализовать нужно и раствор формальдегида, так как технический продукт всегда содержит заметное количество муравьиной кислоты.  Реактивы н оборудование Сульфит натрия, 25%-ный раствор Соляная кислота, 0,1 н. раствор Фенолфталеин, 1%-ный спиртовой раствор Бюкс для изятия навески Колба коническая на 250 мл
Ход определения. Навеску формалина ~3 г, взвешенную в бюксе с точностью до 0,0002 г, переносят в коническую колбу емкостью 250 мл, смывая небольшим объемом дистиллированной воды. Приливают 50 мл 25%-ного раствора сульфита натрия, предварительно нейтрализованного в присутствии индикатора ф/ф до слабо-розовой окраски 0,1 н. соляной кислотой. Выделившуюся в реакции щелочь титруют 1 н. соляной кислотой (до обесцвечивания: розового цвета- щелочная среда до бесцветного-кислая среда). Массовую долю формальдегида ω2 (%) рассчитывают по формуле
где V— объем 1 н. соляной кдалоты, израсходованный на титрование выделившейся щелочи; К — коэффициент поправки для 1 н. соляной кислоты; 0,03 — масса формальдегида, соответствующая 1 см2 точно 1 н. раствора соляной кислоты, г; т — масса навески формалина, г.
Работа 3. Определение массовой доли метилового спирта.Метод основан на реакции окисления метилового спирта раствором бихромата калия в кислой среде. Одновременно со спиртом окислению подвергается и формальдегид:
Поэтому при расчете содержания метилового спирта необходимо из полученного результата вычесть содержание формальдегида в пересчете на метиловый спирт. Избыток бихромата калия определяют иодометрически:
Выделившийся иод оттитровывают тиосульфатом натрия:
Молярную массу эквивалента метилового спирта рассчитывают на основе сопоставления веществ, участвующих в реакциях:
Молярная масса эквивалента метилового спирта равна 1/6массы его моля, т. е. 5, 342 г.
Реактивы и о борудование Бахромат калия приготовление см. разд. 8.1, работа 1) Серная кислота, 30%-иый раствор Иодид калия, 10 %-иый раствор Соляная кислота, 4 и. раствор Тиосульфат натрия, 0,1 и. раствор Крахмал растворимый, 1%-ный раствор Цилиндр мерный на 50 мл Колба коническая на 1 л Бюкс дли взятия иавёски Колба коническая иа 250 мл Пипетки на 25 и 50 мл Колба коническая на 250 мл с пришлифованным холодильником Ход определения. Взвешивают в бюксе ~5 г формалина, переносят в мерную колбу емкостью 500 мл и доводят дистиллированной водой до метки. 25 мл приготовленного раствора переносят в коническую колбу емкостью 250 мл, приливают 25 мл раствора бихромата калия и 50 мл 30% -ной серной кислоты. Колбу присоединяют к обратному холодильнику и нагревают в течение 2 ч на кипящей водяной бане. Затем содержимое переносят в мерную колбу емкостью 500 мл и доводят дистиллированной водой до метки. В литровую коническую колбу наливают 20 мл 10%-ного раствора иодида калия, 20 мл 4 н. соляной кислоты и 50 мл полученного раствора. Общий объем жидкости доводят водой до 500 мл и титруют выделившийся свободный иод 0,1 н. раствором тиосульфата натрия. Когда раствор примет слабо-желтый цвет, добавляют раствор крахмала и продолжают титровать до перехода окраски в светло-зеленую. Одновременно в тех же условиях ставят контрольный опыт. Массовую долю метилового спирта ω3 (%) вычисляют по формуле:
где V1— объем 0,1 н. раствора тиосульфата натрия, израсходованный на контрольный опыт; V2 — объем 0,1 н. раствора тиосульфата натрия, затраченный на титрование в основном опыте; K — коэффициент поправки для 0,1 н. раствора тиосульфата натрия; m — масса навески формалина, г; 0,000534 — масса метилового спирта, соответствующая 1 см3 точно 0,1 н. раствора тиосульфата натрия, г; 0,711 — фактор пересчета формальдегида на метиловый спирт.
Работа 4. Определение массовой доли кислот в пересчете на муравьиную кислоту.Кислоту определяют прямым титрованием щелочью.
Ход определения. Навеску формалина ~ 10 г взвешивают в бюксе, затем переносят в колбу емкостью 250 мл, смывая небольшим объемом дистиллированной воды. Добавляют несколько капель бромтимолового синего в качестве индикатора и титруют 0,1 н. раствором гидроксида натрия до зеленой окраски. Рассчитывают массовую долю кислот ω (%) по формуле
где V— объем 0,1 н. раствора гидроксида натрия; K — коэффициент поправки для 0,1 н. раствора гидроксида натрия; m —масса навески формалина, г; 0,0046 — масса муравьиной кислоты, соответствующая 1 см3 точно 0,1 н. раствора гидроксида натрия, г.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 1255. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |