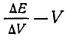Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Потенциометрическое титрование
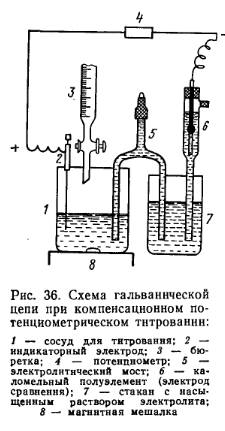
Сущность метода потенциометрического титрования состоит в том, что по мере постепенного прибавления раствора-титранта к исследуемой жидкости конечная точка титрования (точка эквивалентности) определяется по значительному изменению разности потенциалов между двумя электродами. Первый — индикаторный электрод, потенциал которого изменяется с изменением концентрации исследуемого вещества или реактива в растворе, второй — электрод сравнения, потенциал которого при титровании остается постоянным. Изменение потенциала индикаторного электрода в точке эквивалентности называют его скачком. Тит-рант приливают порциями при постоянном перемешивании, в начале титрования большими порциями, а вблизи точки эквивалентности— по 0,1—0,05 мл. После каждой порции измеряют ЭДС цепи. Электрод сравнения и исследуемый раствор соединяют с помощью электролитического моста, обеспечивающего электролитическую проводимость между электродными растворами, но препятствующего их взаимной диффузии. Электролитический мост представляет собой изогнутую стеклянную трубку, заполненную агар-агаром, содержащим хлорид калия. В качестве индикаторного электрода, реагирующего на изменение концентрации определяемого иона в растворе и заменяющего собой индикатор при обычном титровании, применяют металл, потенциал которого зависит от концентрации его соли в растворе (например, серебро для определения концентрации ионов серебра). Для реакции нейтрализации и при определении рН раствора используют хингидронный, сурьмяный или стеклянный электрод (индикаторные электроды) в зависимости от типа реакций, лежащих в основе титрования. Но во всех случаях потенциал должен устанавливаться практически мгновенно в соответствии с концентрацией титруемых ионов и не зависеть от присутствия других ионов.  Электродом сравнения, потенциал которого не изменяется в процессе потенциометрического титрования и служит только для определения потенциала индикаторного электрода, может быть каломельный или хлорсеребряный электрод. При потенциометрическом титровании концентрация участвующих в реакции веществ или ионов, а следовательно, и равновесный потенциал индикаторного электрода все время изменяются. Если значения равновесного потенциала электрода, соответствующие различным моментам титрования, нанести на график, то получится кривая титрования с резким изменением потенциала электрода (скачок потенциала) в эквивалентной точке (см. рис. 37, а). По скачку потенциала определяют конец титрования. Потенциометрический метод анализа позволяет: использовать все типы химических реакций (нейтрализация, окисление — восстановление, осаждение и др.), протекающих количественно; определять в одной пробе несколько совместно присутствующих веществ, не прибегая к их предварительному разделению; проводить титрования сильно окрашенных или мутных растворов, когда обычные цветные индикаторы неприменимы. Существуют компенсационный и некомпенсационный методы потенциометрического титрования. Компенсационный метод является классическим методом измерения разности потенциалов ЭДС гальванических элементов. Он заключается в уравновешивании неизвестной разности потенциалов известной, противоположно направленной. При этом стрелка гальванометра устанавливается на нуле. Титрование проводят следующим образом: в сосуд для титрования (химический стакан) вносят определенное количество исследуемого раствора, погружают в раствор индикаторный электрод и один конец электролитического мостика (рис. 36). Второй его конец опускают в стакан с насыщенным раствором хлорида калия или другого электролита; туда же опускают электрод сравнения — трубку каломельного полуэлемента.
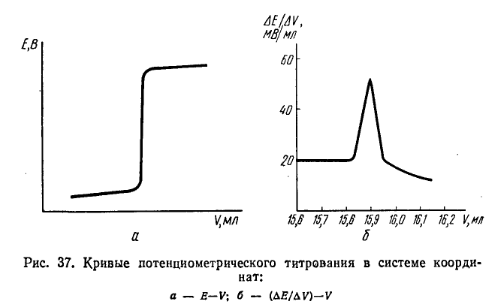
Составленную гальваническую цепь присоединяют к клеммам потенциометра и измеряют ЭДС цепи, а затем приступают к титрованию исследуемого раствора при непрерывном перемешивании его магнитной мешалкой. Титрующий раствор приливают из бюретки, а по мере приближения к точке эквивалентности добавляют лишь по 0,1 или 0,05 мл, каждый раз записывая показания потенциометра в милливольтах. После установления стрелки гальванометра на нуль шкалы. После скачка потенциала индикаторного электрода делают еще 3—4 измерения после прибавления очередных порций титрованного раствора. Для нахождения точки эквивалентности строят график титрования в координатах Е—V, гдеЕ— ЭДС цепи; V—объем титрованного раствора. Точка эквивалентности соответствует точке перегиба кривой (рис. 37, а).
В аналитической практике чаще определяют точку эквивалентности непосредственно по скачку потенциала индикаторного электрода. Для более точного определения точки эквивалентности рекомендуется строить график в координатах
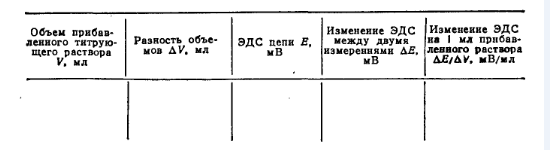
где∆Е— изменение потенциала электрода между двумя порциями добавленного титрованного раствора: ∆V— порция добавленного титрованного раствора. В этом случае кривая потенциометрического титрования имеет максимум (рис. 37, б), который соответствует точке эквивалентности. Запись результатов потенциометрического титрования удобно свести-в таблицу:
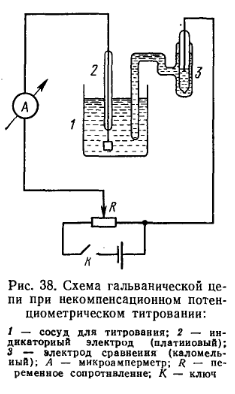
Некомпенсационный метод более удобен, прост в установке и быстрее в определении. Элемент, состоящий из титруемого раствора и погруженной в него пары электродов, через переменное сопротивление присоединяют к полюсам чувствительного измерительного прибора (гальванометра, микроамперметра, милливольтметра). Электрическая схема установки для некомпенсационного потенциометрического титрования приведена на рис.38.
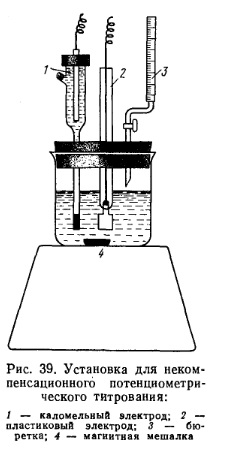
Титрующий раствор приливают из бюретки по каплям при непрерывном перемешивании титруемого раствора. В точке эквивалентности возникает скачок потенциала индикаторного электрода и стрелка измерительного прибора резко отклоняется. Титрование проводят в химическом стакане, закрытом пробкой с отверстиями для платинового электрода, каломельного полуэлемента и бюретки (рис. 39).
Перед началом титрования исследуемого раствора включают магнитную мешалку и с помощью переменного сопротивления устанавливают световой указатель измерительного прибора на нулевое положение шкалы. В начале титрования световой указатель измерительного прибора остается почти неподвижным; при дальнейшем прибавлении рабочего раствора он отклоняется вправо, а затем начинает медленно возвращаться в исходное положение. В это время подачу рабочего раствора производят со скоростью 1 капля в 5 с. Титрование продолжают до тех пор, пока световой указатель измерительного прибора (от одной капли титрованного раствора) не установится на определенном делении шкалы и останется в таком положении в течение 1 мин или за то же время возвратится в исходное положение. Это свидетельствует о конце титрования.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 558. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |