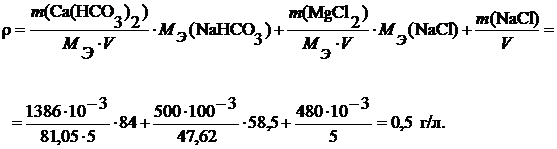Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Определение временной и постоянной жесткости воды по количеству реагентов, необходимых для устранения жесткостиПример 3. Для устранения общей жесткости по известково-содовому методу к 50 л воды добавлено 7,4 г Сa(OH)2 и 5,5 г Na2CO3. Рассчитайте временную и постоянную жесткость воды. Решение. Добавление к воде Сa(OH)2 может устранить временную жесткость, а добавление Na2CO3 – постоянную жесткость. При добавлении этих реагентов к воде происходят следующие химические реакции:
Me(HCO3)2 + Ca(OH)2 = MeCO3↓ + CaCO3↓ + 2H2O,
Me(NO3)2 + Na2CO3 = MeCO3↓ +2NaNO3,
где Ме2+: Ca2+, Mg2+, Fe2+ и др. Временную жесткость воды (Жвр, ммоль/л) измеряют количеством гидроксида кальция, участвующего в реакции, а постоянную жесткость (Жпост) − количеством карбоната натрия.
M(Сa(OH)2) = M / 2 = 74,02 / 2 = 37,04 моль/л;
М(Na2CO3) = M / 2 = 106,00 / 2 = 53,0 моль/л;
Жвр = 7400 / (37,04 ∙ 50) = 4 ммоль/л;
Жпост = 5300 / (53,0 ∙ 50) = 2 ммоль/л.
Общая жесткость воды равна:
Жобщ = Жвр + Жпост = 4 + 2 = 6 ммоль/л.
Определение общей (Жобщ), временной жесткости (карбонатной, Жвр) и постоянной (некарбонатной, Жпост) воды по объему трилона Б и соляной кислоты, пошедших на титрование образца воды Пример 4. Определите общую, карбонатную и некарбонатную жесткость воды, если на титрование ее 100 мл потребовалось 8 мл 0,1 н. раствора трилона Б и 5 мл 0,1 н. раствора соляной кислоты. Решение. Общую и карбонатную жесткость воды можно определить методом титрования. Для определения общей жесткости производится комплексонометрическое титрование пробы анализируемой воды раствором двузамещенной натриевой соли этилендиаминтетрауксусной кислоты (трилон Б) в щелочной среде (рН 8−10) в присутствии индикатора (наиболее часто используют эриохром четный Т или мурексид). Карбонатная жесткость определяется кислотно-основным титрованием воды раствором соляной кислоты в присутствии индикатора метилового оранжевого, фиксируется переход желтой окраски в оранжевую.  Расчет жесткости воды ведется по закону эквивалентов:
где Vв – объем анализируемой пробы воды, мл; Vт – объем титрующего раствора, мл;
После подстановки заданных значений получим:
Жпост = Жобщ – Жвр = 8 – 5 = 3 ммоль/л. Определение жесткости и солесодержания воды Пример 5. Анализ воды показал, что в ней содержатся гидрокарбонат кальция Ca(HCO3)2 массой 1386 мг, хлорид кальция CaCl2 массой 610 мг, хлорид натрия NaCl массой 480 мг. Объем воды составил 5 л. Определите общую жесткость и солесодержание воды. Решение. Общая жесткость воды – суммарная концентрация ионов Ca2+ и Mg2+ , выраженная в ммоль/л. Молярные массы эквивалентов солей, обусловливающих жесткость воды:
M(Ca(HCO3)2) = 162,11 г/моль, Mэ(Ca(HCO3)2) = 162,11 / 2 = 81,05 г/моль;
M(CaCl2) = 111,0 г/моль, Mэ(CaCl2) = 111,0 / 2 = 55,5 г/моль.
Общая жесткость воды равна:
Солесодержание – суммарная концентрация растворенных в воде солей, выраженная в г/л:
Определение жесткости и солесодержания воды после Na-катионирования Пример 6.Природная вода имеет следующие исходные показатели качества: общая жесткость 5,15 ммоль/л, солесодержание 0,47 г/л. Солевой состав воды: 1386 мг Ca(HCO3)2, 500 мг MgCl2 ,480 мг NaCl. Объем воды 5 л. Определите жесткость и солесодержание после Na-катионирования. Решение. При Na-катионировании исходная вода пропускается через слой Na-катионита. При этом ионы Ca2+ и Mg2+ из природной воды обмениваются на ионы Na+ из катионита:
2R−Na+ + Ca2+
2R−Na+ + Mg2+
Обмен происходит по закону эквивалентов:
Молярные массы эквивалентов солей жесткости и солей натрия:
M(Ca(HCO3)2) = 162,11 г/моль, Mэ(Ca(HCO3)2) = 162,11 / 2 = 81,05 г/моль; M(MgCl2) = 95,21 г/моль, Mэ(MgCl2) = 95,21 / 2 = 47,62 г/моль; Mэ(NaHCO3) = 84 г/моль, Mэ(NaCl) = 58,5 г/моль.
Тогда солесодержание Na-катионированной воды будет определяться содержанием в воде солей Na+:
Как видим, после полного Na-катионирования воды ее солесодержание осталось примерно, как в исходной воде. Жесткость воды стала практически нулевой.
|
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 496. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |


 – нормальность титрующего раствора, моль/л.
– нормальность титрующего раствора, моль/л.


 R2−Ca2+ + 2Na+,
R2−Ca2+ + 2Na+, .
.