
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Окислительно-восстановительные потенциалыПримеры решения задач
Пример 1. Какие из металлов (Au, Sn, Mn) могут быть окислены кислородом при 298 К, рН 7 и стандартном состоянии всех веществ? Решение. Окисление металла возможно при условии
Следовательно, вышеуказанное условие соблюдается для олова и марганца, которые могут быть окислены кислородом при рН = 7. Пример 2. Определите стандартную энергию Гиббса образования Li2S, если известно, что стандартная ЭДС элемента с токообразующей реакцией 2Li + CuS = Li2S + Cu равна 2,3 В. Решение. Стандартную энергию Гиббса для данной температуры можно рассчитать по уравнению ΔG = −nFE = − 2 ∙ 96500 ∙ 2,3 = −443,9 кДж. С другой стороны, энергия Гиббса этой реакции равна
Отсюда:
Пример 3. Установите, в каком направлении возможно самопроизвольное протекание реакции:
2NaCl + Fe2(SO4)3 = 2 FeSO4 + Cl2 + Na2SO4.
Решение. Уравнение реакции в ионно-молекулярной форме:
2 Cl− + 2 Fe3+ = 2 Fe2+ + Cl2.
Запишем стандартные электродные потенциалы электрохимических систем, участвующих в реакции: С12 + 2е– Fe3+ + е– Поскольку
Пример 4. Определите направление возможного самопроизвольного протекания реакции 2Hg + 2Ag+ = 2Ag + Hg
при следующих концентрациях (в моль/л) участвующих в реакции ионов а) [Ag+] = 10 −4, [Hg 
Решение. Выпишем значения стандартных электродных потенциалов взаимодействующих электрохимических систем: Hg Ag+ + е– Теперь вычислим значения электродных потенциалов при указанных в задаче концентрациях по уравнению Нернста.
a)
В данном случае б)
В данном случае Контрольные задания
8-1. Какие из металлов (Cu, Ag, Co, Mg) могут быть окислены кислородом в водном растворе при рН = 10, температуре 298 К и стандартных состояниях веществ? Напишите соответствующие уравнения реакций. 8-2. Какие из металлов (Ni, Pt, Zn) могут быть окислены жидким бромом при температуре 298 К и стандартных состояниях веществ? Напишите соответствующие уравнения реакций. 8-3. Какие из металлов (Cd, Au, Cu) могут быть окислены хлором при температуре 298 К и стандартных состояниях веществ? Напишите соответствующие уравнения реакций. 8-4. Какие из металлов (Mn, Pd, Fe) могут быть окислены кислородом в водном растворе при рН = 7, температуре 298 К и стандартных состояниях веществ? Напишите соответствующие уравнения реакций. 8-5. Можно ли получит железо восстановлением водородом магнетита Fe3O4, с образованием водяного пара при стандартных состояниях всех веществ и температуре 298 К? Определите области температур, при которых этот процесс может протекать самопроизвольно при стандартных состояниях всех веществ. Напишите соответствующие уравнения реакций. 8-6. Можно ли получит железо восстановлением магнетита Fe3O4 углеродом с образованием углекислого газа при 298 К и стандартных состояниях всех веществ? Определите области температур, при которых этот процесс может протекать самопроизвольно при стандартных состояниях всех веществ. Напишите соответствующие уравнения реакций. 8-7. Можно ли получит хром восстановлением Cr2O3 водородом с образованием водяного пара при стандартных состояниях всех веществ и температуре 298 К? При каких температурах этот процесс может протекать самопроизвольно при стандартных состояниях всех веществ? Напишите соответствующие уравнения реакций. 8-8. Можно ли получит железо восстановлением монооксидом углерода при 298 К и стандартных состояниях всех веществ? При каких температурах этот процесс может протекать самопроизвольно при стандартных состояниях всех веществ? Напишите соответствующие уравнения реакций. 8-9. Укажите, в каком направлении может самопроизвольно протекать реакция H2O2 + HOCl = HCl + O2 + H2O.
8-10. Укажите, в каком направлении может самопроизвольно протекать реакция 2 HIO3 + 5 H2O2= 5O2 + I2 + 6H2O.
8-11. Укажите, в каком направлении может самопроизвольно протекать реакция I2 + 5 H2O2 = 2 HIO3+ 4H2O. 8-12. Может ли данная реакция протекать самопроизвольно?
Н3РO4 + 2 HI = H3PO3 + I2 + H2O.
8-13. Может ли данная реакция протекать самопроизвольно?
Н3РO3 + SnCl2 + H2O = 2HCl + Sn + Н3РO4.
8-14. Может ли данная реакция протекать самопроизвольно?
Н3РO3 + AgNO3 + H2O = 2Ag +2HNO3 + Н3РO4.
8-15 Может ли данная реакция протекать самопроизвольно?
Н3РO3 + Pb(NO3) 2 + H2O = Pb +2HNO3 + Н3РO4.
8-16. Может ли самопроизвольно протекать реакция взаимодействия водного раствора перманганата калия на серебро: MnO
8-17. Может ли самопроизвольно протекать реакция взаимодействия водного раствора перманганата калия на серебро: MnO
8-18. Может ли самопроизвольно протекать реакция взаимодействия водного раствора перманганата калия на серебро:
MnO 8-19. Может ли приведенная реакция протекать в нейтральном растворе MnO
8-20. Может ли приведенная реакция протекать в нейтральном растворе MnO
8-21. Может ли приведенная реакция протекать в нейтральном растворе MnO
8-22. Будет ли протекать реакция в водном растворе
FeCl3 + Hg = FeCl2 + 2 HgCl2,
если [Hg2+] = 10 −2 моль/л, [Fe2+] = 10 −2 моль/л, [Fe3+] = 10 −3 моль/л? 8-23. Будет ли протекать реакция в водном растворе
FeCl2 + 2 HgCl2 = FeCl3 + Hg,
если [Hg2+] = 10 −2 моль/л, [Fe2+] = 10 −2 моль/л, [Fe3+] = 10 −3 моль/л? |
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 656. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 . Потенциал кислородного электрода при 298 К, относительном парциальном давлении кислорода, равном 1 и рН = 7, равен 0,8 В. Стандартные потенциалы металлов равны
. Потенциал кислородного электрода при 298 К, относительном парциальном давлении кислорода, равном 1 и рН = 7, равен 0,8 В. Стандартные потенциалы металлов равны = − 0,136 В,
= − 0,136 В,  = − 1,18,
= − 1,18,  = 1,498 В.
= 1,498 В. =
=  2С1–,
2С1–,  = 1,36 В,
= 1,36 В, = 0,77 В.
= 0,77 В. >
>  , то окислителем будет являться хлор, а восстановителем – ион Fe2+, рассматриваемая реакция будет протекать справа налево.
, то окислителем будет являться хлор, а восстановителем – ион Fe2+, рассматриваемая реакция будет протекать справа налево. ,
, ]= 10 −1, б) [Ag+]= 10 −1, [Hg
]= 10 −1, б) [Ag+]= 10 −1, [Hg 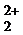 + 2е–
+ 2е–  = 0,79 В,
= 0,79 В, = 0,80 В.
= 0,80 В.

 >
>  , реакция будет протекать справа налево.
, реакция будет протекать справа налево.

 + Ag = MnO
+ Ag = MnO  + Ag+.
+ Ag+. + 3Ag + 2H2O = MnO2 + 3Ag+ + 4OH –
+ 3Ag + 2H2O = MnO2 + 3Ag+ + 4OH – + 8Н+ + 5 Ag = Mn2+ + 5Ag+ + 4H2O.
+ 8Н+ + 5 Ag = Mn2+ + 5Ag+ + 4H2O. + Сl− = MnO2+ Cl2?
+ Сl− = MnO2+ Cl2? + I− = MnO2+ I2?
+ I− = MnO2+ I2?