
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Расчет растворимости труднорастворимого электролита поЗначению ПР. Влияние ионной силы раствора Пример 4. Вычислите растворимость хлорида серебра: а) в воде при 25 °С; б) в 0,01 М растворе нитрата калия. Решение. а) Вычисляем растворимость соли в воде 1. 2. Пусть молярная концентрация насыщенного раствора AgCl равна x, тогда
откуда б) Вычисляем растворимость хлорида серебра в 0,01 М раствора нитрата калия. 1. Поскольку к малорастворимому веществу добавлен раствор сильного электролита, необходимо использовать термодинамическую константу растворимости:
Находим ионную силу раствора, она будет определяться концентрацией нитрата калия в растворе. Концентрации ионов Ag+ и Cl-, образующихся при растворении настолько малы, что их влиянием на величину ионной силы раствора можно пренебречь.
При ионной силе 0,01 коэффициенты активности ионов
откуда что соответствует растворимости хлорида серебра в 0,01 М растворе Таким образом, растворимость AgCl в 0,01 М растворе Введение в раствор одноименных с осадком ионов приводит к сдвигу равновесия и соответственно, к уменьшению растворимости осадка, т.е. способствует более полному осаждению твердой фазы. На этом основано действие избытка осадителя для достижения полноты осаждения. Однако следует отметить, что в некоторых случаях при введении в раствор избыточного количества ионов, одноименных с осадком, растворимость осадка может увеличиваться вследствие образования растворимых комплексов.
Таблица 1
Коэффициенты активности (γ) ионов при различных  Ионных силах раствора
Расчет растворимости труднорастворимого электролита по Значению ПР. Влияние одноименных ионов Пример 5. Растворимость оксалата кальция Решение. 1. В растворе происходят процессы, которые можно описать уравнениями:
2. 3. Если молярную концентрацию насыщенного раствора 4. Тогда отсюда Сравнивая это значение с растворимостью данного осадка в воде, находим, что растворимость снизилась в 210 раз:
В кислой среде растворимость осадка, представляющего собой соль слабой кислоты, повышается по сравнению с растворимостью его в чистой воде. Причем повышение растворимости тем больше, чем больше произведение растворимости малорастворимого электролита, чем ниже значение рН и чем меньше константа диссоциации слабой кислоты, образующей данную соль. Контрольные задания 1-1. Растворимость сульфида серебра в воде составляет 2,146 ∙ 10-5 г/100 г воды. Вычислите ПР соли. 1-2. В 500 мл насыщенного раствора содержится 9,5 ∙ 10-4 г AgCl. Вычислите ПР хлорида серебра. 1-3. При температуре 20 °С растворимость карбоната кальция равна 1,3 ∙ 10-4, а бромида свинца - 2,7 ∙ 10-2 моль/л. Найдите произведение растворимости этих солей. Как повлияет на растворимость бромида свинца добавление бромида калия? 1-4. Растворимость сульфата бария в воде при комнатной температуре равна 1,05 ∙ 10-5 моль/л. Вычислите ПР сульфата бария, и сравните полученные данные сравните с табличными значениями. 1-5. Выпадет ли осадок хлорида серебра, если к 10 мл 0,01 М раствора нитрата серебра прибавить 10 мл 0,01 М раствора хлорида натрия. 1-6. Выпадет ли осадок, если к 1 л 0,1 н. раствора хлороводородной кислоты прибавить 1 мл 0,01 н. раствора нитрата серебра? 1-7. Выпадет ли осадок хлорида свинца (II) (ПР = 2,4 ∙ 10−4) при смешении 0,05 н. раствора нитрата свинца с равным объемом 0,05 н. раствора НCl? 1-8. При какой величине рН начнется осаждение Fe(OH)3 при добавлении раствора NaOH к 0,1 М раствору FeCl3? 1-9. Выпадет ли осадок CdS при насыщении сероводородом 0,01 М раствора CdCl2, рН которого равен 2? ПР(CdS) = 3,6∙10−29. 1-10. Вычислите растворимость хромата свинца (II) (в граммах на 1 л): а) в воде; б) в 0,1 М растворе хромата калия. ПР(PbCrO4) = 1,8∙10−14. 1-11. По произведениям растворимости сульфата свинца (II) (2,2 ∙ 10-8) и иодида свинца (II) (8,7 ∙ 10-9) рассчитайте растворимость этих солейв граммах на 1 л. Почему соль с меньшим значением ПР имеет большую растворимость? 1-12. Сколько граммов хлорида серебра может раствориться: а) в 500 мл воды; б) в 100 мл 0,1 М раствора KCl? 1-13. Во сколько раз растворимость оксалата кальция (ПР = 2,5 ∙ 10-9) в о0,01 М растворе оксалата аммония меньше по сравнению с растворимостью в чистой воде? 1-14. Какой осадок выпадает первым, если к раствору, содержащему ионы Ва2+, Sr2+ в равных концентрациях, постепенно приливать раствор серной кислоты? 1-15. В 1 л раствора содержится 20 мг ионов Ag+ и 20 мг ионов Pb2+. Какая соль выпадает в осадок первой при добавлении по каплям раствора K2CrO4? |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 1090. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 ;
;  .
. ;
;  ,
, моль/л, что соответствует растворимости данной соли в воде.
моль/л, что соответствует растворимости данной соли в воде. .
.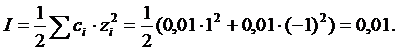
 и
и  равны 0,90 (таблица 1).
равны 0,90 (таблица 1). ,
, моль/л,
моль/л, .
. , чем в чистой воде.
, чем в чистой воде. в воде равна
в воде равна  моль/л. Вычислите растворимость этой соли в 0,01 М растворе оксалата аммония
моль/л. Вычислите растворимость этой соли в 0,01 М растворе оксалата аммония  .
. (диссоциация), (1)
(диссоциация), (1) (гетерогенное равновесие). (2)
(гетерогенное равновесие). (2)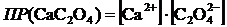 ;
;  .
. =x (в соответствии с уравнением (2)); общая концентрация оксалат ионов будет равна сумме 0,01 моль/л за счет диссоциации оксалата аммония и x моль/л за счет растворимости оксалата кальция, т.е
=x (в соответствии с уравнением (2)); общая концентрация оксалат ионов будет равна сумме 0,01 моль/л за счет диссоциации оксалата аммония и x моль/л за счет растворимости оксалата кальция, т.е  моль/л.
моль/л. ,
, моль/л, что соответствует растворимости осадка
моль/л, что соответствует растворимости осадка  в 0,01 М растворе
в 0,01 М растворе  .
. .
.