
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ТЕМА 4. ХИМИЧЕСКИЕ ВОПРОСЫ ЭКОЛОГИИЛитература
[1], гл. XV, §§ 15.1-15.4; вопросы для самоконтроля: с.478, c. 490, c. 496, № 15.1 – 15.11; c. 275, c. 285, № 9.10 – 9.17/ [4], гл. II, § 2.5, с. 37 – 45; [4], гл. III, § 3.1, с. 69 – 138; [6], гл. I, с. 7 – 15; [7], с.10 – 103; [8], гл. II, § 2.1 – 2.6; с. 26 – 57. [11], гл. II, § 2.1 – 2.6, с. 28 – 70.
Вопросы для самопроверки 1. Охарактеризуйте особенности воздействия энергетики на природную окружающую среду. 2. Какова роль химии в решении экологических проблем общества? 3. Назовите основные токсичные выбросы теплоэнергетического оборудования в атмосферу и в водный бассейн. 4. Объясните процессы превращения выбросов энергетики в атмосфере и гидросфере. Составьте уравнения соответствующих реакций. 5. Кислотные дожди: причины возникновения и последсвия их воздействия на окружающую среду. 6. Приведите источники и механизм появления серной кислоты в атмосфере. 7. Какие новые технологии используют для очистки сточных вод. 8. Биоэнергетика. Перечислите основные виды биотоплива. 9. Что может служить сырьем для производства биотоплива? 10. Какова доля растительной биомассы в мировом потреблении энергии? 11. Каковы причины слабого развития биоэнергетики в России? ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ. КОНТРОЛЬНЫЕ ЗАДАНИЯ
Каждый студент выполняет вариант контрольной работы, обозначенный двумя последними цифрами его учебного шифра в зачетной книжке. Химическое равновесие. Закономерности химического равновесия в гетерогенных системах. Произведение растворимости Применяя закон действующих масс к гетерогенным системам осадок – насыщенный раствор, равновесие в них характеризуют константой равновесия, называемой произведением растворимости (ПР). Произведение растворимости малорастворимого сильного электролита есть произведение равновесных молярных концентраций катионов и анионов этого электролита в водном растворе.  Для хлорида серебра (I):
Для ортофосфата кальция:
Если в растворе произведение концентраций электролита (ИП) выше значения ПР, то избыточное количество вещества выпадет в осадок. Как и всякая другая константа равновесия, величина ПР зависит от температуры, так как растворимость вещества (концентрация насыщенного раствора) изменяется при повышении или понижении температуры. Для малорастворимых сильных электролитов, растворимость которых с ростом температуры увеличивается, произведение растворимости увеличивается.
Примеры решения задач
Расчет возможности образования осадков Пример 1.Образуется ли осадок карбоната свинца при смешивании 400 мл 0,001 М раствора нитрата свинца и 100 мл 0,01 М раствора карбоната калия? Решение. 1. Находим молярные концентрации веществ в момент смешивания растворов по формуле:
2. Концентрации ионов образующих осадок равны:
3. ИП = 4. Полученное значение произведения концентрации ионов больше
Пример 2. При какой величине рН начнется осаждение гидроксида цинка из 0,1 М раствора его соли, если ПР =7,1∙10-18. Решение. 1. 2. Рассчитываем концентрацию гидроксил ионов:
3. Осаждение гидроксила цинка из раствора соли цинка с концентрацией 0,1 моль/л начинается при рН, равном 5,92. Пример 3. Образуется ли осадок СаСО3 при смешивании равных объемов 0,02 М растворов хлористого кальция и углекислого натрия? (ПР(СаСО3) = 1,0∙10-3). Решение. При смешивании равных объемов растворов CaCl2 и Na2CO3 объем смеси увеличивается в 2 раза, поэтому концентрация каждого из ионов уменьшается в 2 раза. Следовательно, [CaCl2]= [Ca2+] = 0,02 ∙ 0,5=1∙10-2 моль/л. [Na2CO3] = [CО Откуда [Ca2+]∙[CО |
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 226. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
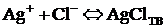 ;
;  (25 °C).
(25 °C). ;
;  (25 °С).
(25 °С). моль/л.
моль/л. моль/л.
моль/л. моль/л и
моль/л и  моль/л.
моль/л. .
. , следовательно, раствор пересыщен относительно карбоната свинца и осадок образуется.
, следовательно, раствор пересыщен относительно карбоната свинца и осадок образуется. ;
; 
 моль/л.
моль/л.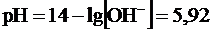 .
.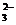 ] = 0,2∙0,5 = 1∙10-2 моль/л.
] = 0,2∙0,5 = 1∙10-2 моль/л.