
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Технологические показатели качества водыКонтрольные задания
5-1. Дайте характеристику показателям воды, указанным в Вашем задании. Какая количественная величина при этом экспериментально определяется? Жесткость воды. 5-2**. Карбонатная жесткость воды. 5-3**. Некарбонатная жесткость воды. 5-4**. Кислотность (реакция среды). 5-5**. Щелочность воды. 5-6**. Солесодержание воды. 5-7**. Окисляемость воды. 5-8**. Временная жесткость воды. 5-9**. Постоянная жесткость воды. 5-10**. Биохимическая потребность в кислороде. 5-11**. Цветность воды. 5-12**. Запах воды. 5-13**. Взвешенные вещества в воде. 5-14**. Сухой осадок. 5-15**. Прокаленный остаток. 5-16**. Содержание угольной кислоты в воде. 5-17**. Содержание аммиака и солей аммония в воде. 5-18**. Прозрачность воды. 5-19**.Содержание хлорид-ионов в воде. 5-20**. Содержание кислорода в воде. _________ ** - см. условие задачи 5-1. Жесткость воды Примеры решения задач Определение общей жесткости воды по массе содержащихся в воде солей
Пример 1.Рассчитайте общую жесткость воды (ммоль/л), если в 0,25 л воды содержится 16,2 мг гидрокарбоната кальция, 2,92 мг гидрокарбоната магния, 11,10 мг хлорида кальция и 9,50 мг хлорида магния. Решение.Выразим жесткость воды (ммоль/л) двухзарядных катионов металлов Са2+, Mg2+, Fe2+ и соответствующих им солей, содержащихся в 1 л воды:
где m1, m2, m3 – масса двухзарядных катионов металлов (или соответствующих им солей) в воде, мг; М1, М2, М3 – молярная масса эквивалентов катионов металлов (или соответствующих им солей); V – объем воды, л. Определяем молярные массы эквивалентов солей, обусловливающих жесткость воды:
Общая жесткость данного образца воды (ммоль/л) обусловлена содержанием в ней всех растворимых солей и равна сумме временной и постоянной жесткости: 
Определение временной (гидрокарбонатной, Жк) жесткости воды по объему соляной кислоты, пошедшей на ее титрование Пример 2.Найдите временную жесткость воды, если на титрование 0,1 л образца воды, содержащей гидрокарбонат магния, израсходовано 7,2 ∙ 10−3 л 0,14 н. соляной кислоты. Решение. При титровании воды соляной кислотой происходит следующая химическая реакция:
Mg(HCO3)2 + 2HCl
В соответствии с законом эквивалентов количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. На титрование 0,1 л воды израсходовано 0,14 ∙ 7,2 ∙ 10−3 моль HCl. Следовательно, такое же количество ионов магния содержится в воде, то есть
VHCl ∙ CHCl = Vводы ∙ Cводы,
Жк = Своды = 9,36 ммоль/л.
Жесткость данного образца воды равна 9,36 ммоль/л.
|
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 320. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 ,
,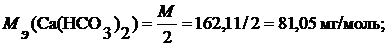




 MgCl2 + 2CO2↑ + 2H2O.
MgCl2 + 2CO2↑ + 2H2O.