
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Константы диссоциации некоторых слабых электролитовВ водных растворах
Пример 4. Рассчитайте как изменится рН 0,05 М раствора КОН при введении в него 0,05 моль/л КСl. Решение. При добавлении к раствору щелочи сильного электролита KCl молярная концентрация ОН− не изменится. Однако возрастет ионная сила раствора, что приведет к уменьшению коэффициента активности ионов, снижению активности гидроксид-ионов ( 1. Рассчитаем рН раствора чистой щелочи. Согласно уравнению диссоциации КОН → К+ + ОН−, концентрация ОН− равна 0,05 моль/л. Ионная сила данного раствора:
Для однозарядных ионов находим коэффициент активности (таблица 1) γ = 0,85. Тогда, 
а = γ ∙ [ОН−] = 0,85∙0,05 = 0,043 и
рН = 14 – 1,37 = 12,63.
2. Рассчитаем рН после добавления в раствор КОН соли KCl. Хлорид калия диссоциирует нацело: КCl → К+ + Cl−и дает в раствор 0,05 моль/л ионов К+ и столько же ионов Cl−. Следовательно, ионная сила такого раствора с учетом всех видов ионов станет равной
При такой ионной силе γ = 0,8, рОН = − lg0,8∙0,05 = 1,4,
рН = 14 − 1,4 = 12,6.
Таким образом, рН уменьшится с 12,63 до 12,6. Контрольные задания
3-1. Вычислите степень диссоциации NH4OH в 0,05 М и 0,5 М растворах при 298 К. Сформулируйте как степень диссоциации зависимость от концентрации электролита. 3-2. Вычислите рН 0,01 М LiOH и 0,01 М NH4OH. Объясните различие в значениях рН для этих растворов. 3-3. Вычислите рН 0,05 М раствора НNO3 и 0,05 М раствора СН3СООН. Объясните различие в значениях рН. 3-4. Определите активность ионов Н+ и ОН− в некотором растворе при 298 К и рН = 4,6. 3-5. Рассчитать ионную силу раствора и активности всех ионов в растворах следующего состава: 1) 0,005 М HCl и 0,001 M CaCl2; 2) 0,01 М NaCl и 0,005 M Sr(OH)2. 3-6. Напишите уравнения ступенчатой диссоциации H3BO3 и Pb(OH)2, а также выражения для констант диссоциации по каждой из ступеней. 3-7. Найдите молярную концентрацию раствора электролита, если степень его диссоциации (α) в этом растворе равна: а) HF (α= 0,15), б) NH4OH (α= 0,1), в) HCOOH (α = 0,05). 3-8. При какой молярной концентрации серной кислоты недиссоциированными остаются: а) 50 % молекул кислоты, б) 80 % молекул кислоты? 3-9. Степень диссоциации в 0,05 М растворе HCN равна 1,26∙10−4. При какой концентрации раствора она увеличится в 5 раз. 3-10. Чему равны концентрации ионов [Н+] и [ОН−] в 0,01 М растворах: а) СН3СООН, б) HBrО, в) NH4OH. 3-11. Рассчитайте равновесные концентрации продуктов диссоциации по 1-ой и 2-ой ступеням в 0,01М растворе угольной кислоты H2CO3. 3-12. В 0,06 М растворе слабого бинарного электролита осталось недиссоциированных 0,055 моль/л молекул. Рассчитайте степень диссоциации в таком растворе. 3-13. Как изменится рН 0,03 М раствора щавелевой кислоты Н2С2О4 при разбавлении его в 10 раз? 3-14. Рассчитайте как изменится рН 0,001 M раствора Ва(ОН)2 при добавлении к нему 0,04 моль/л ВаСl2. 3-15. Рассчитайте концентрацию ионов водорода Н+ в водном растворе муравьиной кислоты, если ее степень диссоциации равна 0,03. 3-16. Рассчитайте молярную концентрацию ионов водорода в водных растворах, в которых концентрация гидроксид-ионов в (моль/л) составляет: а) 10−4; б) 3,2∙10−6. 3-17. Рассчитайте рН растворов, в которых концентрация ионов Н+ (моль/л) равна: а) 2,7∙10−10; б) 8,1∙10−3. 3-18. Рассчитайте рН раствора, в 1 л которого содержится 0,1 г гидроксида натрия. 3-19. Рассчитайте в растворе [Н+], [ОН−], рН которого равен 6,2. 3-20. Рассчитайте рН растворов, в которых концентрация ионов ОН−в (моль/л) равна: а) 5∙10−6; б) 9,3∙10−9. 3-21. В 3 л воды растворен 1 л углекислого газа (н.у.). Рассчитайте рН раствора. 3-22. В 7 л воды растворено 4 л углекислого газа (н.у.). Рассчитайте рН раствора. Химия воды Примеры решения задач Пример 1. Определите пространственную структуру молекулы H2S. Почему валентный угол чуть больше 90º? Решение. Ковалентные связи в молекуле H2S образуется перекрыванием двух р-орбиталей атома серы с двумя s-орбиталями двух атомов водорода (рис. 1). Вследствие пространственной ориентации р-орбиталей атома серы молекула H2S имеет угловую структуру. Из-за незначительного размера атома серы области повышенной электронной плотности сильнее отталкиваются и угол увеличивается (по сравнению с аналогами серы – селеном и теллуром).
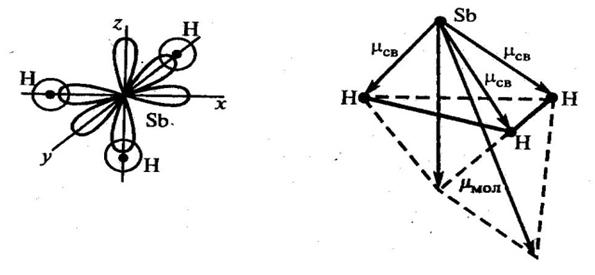
Рис. 1. Электронная схема образования молекулы H2S. Пример 2. Одинаковая ли полярность молекул SbH3 и BH3? Решение. Для оценки полярности молекулы используют величину электрического момента диполя молекулы µм, равную векторной (геометрической) сумме электрических моментов диполей всех связей µсв (и неподеленных электронных пар). У не полярных молекул эта сумма равна нулю (µм=0), у полярных больше 0 (µм>0). Связи в молекуле SbH3 образуются перекрыванием трех р-орбиталей атома сурьмы (5s25р3) с тремя s-орбиталями трех атомов водорода(1s1) (рис. 2а). Поскольку 3р-облака ориентированы в трех взаимно перпендикулярных направлениях (по осям x, y, z), то связи в образовавшейся молекуле SbH3 направлены от вершин тригональной пирамиды, в которой находится атом сурьмы, к ее основанию, в вершинах которого находятся атомы водорода. Следовательно, молекула SbH3 имеет пирамидальную структуру (рис. 2б).
а б
Рис. 2. Электронная схема образования и геометрическая структура молекулы SbH3. Сумма векторов моментов диполей всех связей в молекуле SbH3 не равна нулю и, следовательно, молекула в целом полярна. Ковалентные полярные связи в молекуле BH3 образуются перекрыванием трех гибридных орбиталей атома бора (2s12р2) с s-орбиталями трех атомов водорода. Гибридные связи направлены под углом 120º (рис. 3а). Ядра всех взаимодействующих атомов лежат в одной плоскости. Молекула имеет структуру плоского треугольника. Векторная сумма электрических моментов диполей связей в молекуле равна нулю, следовательно, молекула BH3 неполярна (рис. 3б).
Рис. 3. Электронная схема образования и геометрическая структура молекулы BH3.
Пример 3.Объясните закономерность увеличения температуры кипения в ряду бинарных соединений: NH3, HF, H2O. Решение. В данном ряду между молекулами помимо вандерваальсовых сил действуют водородные связи, возникающие между протоном Н+ одной молекулы и электроотрицательным элементом (N, F, O). Меньшую температуру кипения в аммиаке по сравнению с водой можно объяснить образованием менее прочных водородных связей, так как, азот менее электроотрицателен, чем кислород, и молекула NH3 имеет только одну неподеленную пару электронов, способную оттягивать протон от соседней молекулы. Кислород имеет две неподеленые пары электронов. Вместе с тем HF тоже не столь прочно связан водородными связями, как H2O, несмотря на большую электроотрицательность фтора по сравнению с кислородом и наличие у фтора трех неподеленных пар электронов. Молекулы HF содержат по одному атому водорода, который может использоваться для образования водородных связей. Поэтому молекулы HF не столь прочно связаны водородными связями, как молекулы воды, кислород которых имеет две неподеленные пары электронов и каждая молекула содержит по два атома водорода для образования водородных связей.
Контрольные задания 4-1. Определите, при каких температурах при стандартном давлении термодинамически возможно разложение воды на водород и кислород. 4-2. Правильно ли утверждение, что 1 моль воды при 273К занимает объем 22,4л? Ответ обоснуйте. 4-3. Жидкая вода – это результат ассоциации молекул воды. Как это можно объяснить? 4-4. Какие химические связи ответственны за тетраэдрическую структуру воды в твердом состоянии? 4-5. Как будет изменяться электропроводность дистиллированной воды при длительном хранении ее в открытой бутыли? Какие процессы ответственны за эти изменения? Запишите уравнения химических процессов, объясняющих изменения в характеристиках дистиллированной воды. 4-6. Запишите процессы, происходящие при электролизе воды на инертных электродах. Как можно объяснить свойства воды в одном процессе выступать в роли и окислителя и восстановителя? 4-7. Чем объясняется полярный характер связей в молекуле воды? Почему электропроводность дистиллированной воды намного меньше электропроводности природной воды? Какую воду используют для электролиза? 4-8. Поясните, почему молекулу воды называют диполем? 4-9. Какую пространственную структуру имеют молекулы воды? Почему валентный угол НОН больше 90 ºС? 4-10. Воду относят к самоионизирующим растворителям. Поясните эту характеристику, и чем она обусловлена. 4-11. Среди приведенных процессов выберите реакции, которые не являются окислительно - восстановительными: 1. Cu(OH)2 = CuO↓ + H2O (реакция идет при нагревании). 2. Na2CO3 + H2O 3. 2H2 + O2 = 2H2O. 4. Ca(HCO3)2 = CaCO3 + H2O + CO2 (реакция идет при нагревании). 5. N2 H4 + O2 = N2 + 2H2O. 6. CH4(Г) + H2O(Г) 7. 2H2O = 2H2 + O2 (реакция идет при нагревании). 8. NaH + H2O = NaOH + H2. 9. Ca + 2H2O = Ca(OH)2 + H2. Для каждой из выделенных реакций укажите ее тип. 4-12. Каким критерием следует пользоваться, чтобы среди приведенных процессов выделить реакции, которые не являются окислительно-восстановительными? 1. H2O 2. CaO + H2O = Ca(OH)2 3. CuSO4 + 5H2O = CuSO4·5H2O 4. 2H2O(электролиз) = 2H2+ O2 5. CO + 2H2 = CH3OH (реакция идет в присутствии катализаторов) 6. CO + H2O = CO2 + H2 (реакция идет при нагревании в присутствии катализаторов) 7. CH4 + 2H2O = CO2 + 4H2(реакция идет при нагревании в присутствии катализаторов) 8. 2H2O2 = 2H2O + O2 9. CO2 + H2O Для каждой из выделенных реакций укажите ее тип. 4-13. Углекислый газ, растворяясь в воде, образует слабую угольную кислоту, которая обратимо диссоциирует по двум ступеням с образованием двух видов анионов. Между угольной кислотой и ее анионами устанавливается равновесие, называемое углекислотным. Выразите словесные описания всех процессов соответствующими уравнениями реакций. Назовите анионы угольной кислоты. 4-14. Какие воздействия смещают углекислотное равновесие, делая воду агрессивной? Поясните эту характеристику воды. 4-15. Воду, в которой сосуществуют частицы углекислотного равновесия, называют либо стабильной, либо агрессивной. Поясните эти характеристики воды, используя уравнения углекислотного равновесия. 4-16. Какие воздействия вызывает нагревания воды, в которой установилось углекислотное равновесие? Объясните ожидаемые процессы, запишите соответствующие уравнения реакций 4-17. Какие изменения вызовет добавления гашеной извести в воду, в которой установилось углекислотное равновесие? Запишите уравнения реакций, которые были в системе до и после прибавления гидроксида кальция. 4-18. Термодинамические характеристики процесса растворения твердых, жидких и газообразных веществ в воде. 4-19. Вода как лиганд в комплексных соединениях, прочность связи с комплексообразователем, проявляемая дентатность. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 496. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 ) и, следовательно, к изменению рН.
) и, следовательно, к изменению рН.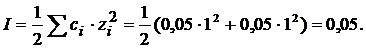




 NaOH + NaHCO3.
NaOH + NaHCO3.