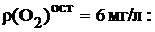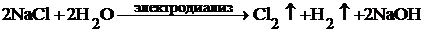Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Химические и электрохимические методы очистки водыПример 1. Определите массы реагентов, требуемых для полного умягчения воды, если природная вода имеет следующие показатели жесткости (моль-экв/л): Жк = 3,3; Жнк = 2,2. Объем воды V = 5 л. Солевой состав воды Cа(HCO3)2 и MgCl2. Решение. Умягчение воды методом осаждения – это обработка воды химическими реагентами: солью и известью. В результате образуются труднорастворимые вещества CaCO3 и Mg(OH)2, выделяемые из воды фильтрованием. При добавлении в воду извести Са(ОН)2 снижается карбонатная жесткость воды
Cа(HCO3)2 + Са(ОН)2 → 2CaCO3(к) + 2Н2О.
При добавлении в воду соды Na2CO3 снижается некарбонатная жесткость воды
Na2CO3 → 2Na+ + CO32−, CO32− + H2O ↔ HCO3− + OH−, Mg2+ + 2OH- → Mg(OH)2(к).
Массу используемых реагентов можно определить по закону эквивалентов:
m(Cа(ОН)2) = Жк · 10–3 · V · Mэ(Са(ОН)2), m(Na2CO3) = Жнк · 10–3 · V · Mэ(Na2CO3).
Молярные массы эквивалентов реагентов Мэ,Ca(OH)2 = 37 г/моль; Мэ,Na2CO3 = 53 г/моль. Определим массы реагентов для умягчения воды mCa(OH)2 = 3,3 · 10−3 · 5 · 37 = 0,611 г = 611 мг, mNa2CO3 = 2,2 · 10−3 · 5 · 53 = 0,583 г = 583 мг. Пример 2. Общая жесткость воды Жо = 5,5 ммоль экв/л, карбонатная жесткость Жк = = 3,3 ммоль экв/л. Объем воды V= 5л. Определите массу осадка, выпавшего при термическом умягчении воды. Решение. При термическом умягчении воды происходит снижение карбонатной жесткости в соответствии с реакцией Ca(HCO3)2 → CaCO3(к) + CO2 + H2O Массу образовавшегося карбоната кальция CaCO3 можно определить по закону эквивалентов: m(СaCO3)= Жк · 10-3V Мэ,CaCO3. Молярная масса CaCO3 МCaCO3 = 100 г/моль. Молярная масса эквивалента CaCO3 Мэ,CaCO3 = 50 г/моль, тогда mСaCO3 = 3,3 · 10-3 · 5 · 50 = 0,825 г. Определим, сколько карбоната кальция растворится в 5 л воды. Согласно табличным данным, произведение растворимости ПРСaCO3 = 4,8 · 10-9. Предельная растворимость в воде карбоната кальция: 
предельная масса растворенного в 5 л воды карбоната кальция: mр,СaCO3 = cрMСaCO3 V = 6,9 · 10-5 · 100 · 5 = 0,035 г. Таким образом, в осадок при термическом умягчении воды выпадет ΔmСaCO3 = mСaCO3 – mр,СaCO3 = 0,825 – 0,035 = 0,79 г. Остаточная жесткость воды после ее термического умягчения будет практически равна некарбонатной жесткости 2,2 ммоль экв/л. Пример 3. Для восстановления кислорода в воду вводят восстановители (Na2SO3 и/или N2H4). Пусть 20 м3 природной воды содержат 14 мг/л кислорода (О2). Для частичного восстановления кислорода в воду ввели 63 мг/л сульфита натрия Na2SO3. Определите, сколько кислорода осталось в воде и сколько гидразина N2H4нужно ввести в воду для полного ее обескислороживания. Решение. Молярные массы реагентов: Мэ(О2) = 32 г/моль, Мэ(Na2SO3) = 126 г/моль, Мэ(Na2SO3) = 32 г/моль. Реакция обескислороживания воды с помощью сульфита натрия протекает по уравнению: 2Na2SO3 + О2 → 2Na2SO4.
Из уравнения реакции следует, что 2 моль Na2SO3 взаимодействуют с 1 моль О2. Исходя из этого, можно составить пропорцию и определить изменение концентрации кислорода ρ(О2), прореагировавшего с заданной массой сульфита натрия:
Остаточное количество растворенного кислорода после частичного обескислороживания воды:
Реакция обескислороживания воды с помощью гидразина протекает по уравнению: N2H4 + О2 → 2N2 + 2Н2О.
Из уравнения химической реакции видно, что 1 моль гидразина взаимодействует с 1 моль кислорода. Составим пропорцию и определим концентрацию гидразина ρ(N2H4), необходимого для связывания остаточного кислорода
В расчете на заданный объем воды 20 м3 количество требуемого гидразина составит: m(N2H4) = 6∙10−3∙20∙103 = 120 г. Контрольные задания 7-1. Химические способы умягчения воды. Запишите соответствующие уравнения реакций. 7-2. Термические способы умягчения воды. Запишите соответствующие уравнения реакций. 7-3. Классификация воды по жесткости. Какие значения концентраций солей жесткости по этой классификации предлагаются? 7-4. Безреагентные способы умягчения воды. Запишите уравнения реакций, на которых основаны эти методы. 7-5. Запишите уравнения процессов при пропускании воды через ионообменную систему. К какому типу химических реакций относятся происходящие реакции? 7-6. Какие вещества называют ионитами? Почему их так называют? Как их классифицируют? Какое применение иониты нашли в технологии воды? 7-7. В технологии воды иониты используются в виде ионообменных колонок, подготовка которых в рабочее состояние проводится по определенной методике. Какие подготовленные ионообменные колонки необходимо подобрать, чтобы проба воды, пропущенная через них, имела на выходе нейтральную среду? Опишите и выразите уравнениями происходящие процессы. Какая реакция отвечает за характер среды у воды в конце технологического процесса? 7-8. В технологии воды иониты используются в виде ионообменных колонок, подготовка которых в рабочее состояние проводится по определенной методике. Какие подготовленные ионообменные колонки необходимо подобрать, чтобы проба воды, пропущенная через них, имела на выходе щелочную среду? Опишите и выразите уравнениями происходящие процессы. Какая реакция отвечает за характер среды у воды в конце технологического процесса? 7-9. Воду, пропущенную через систему Н-катионитов и ОН-анионитов, называют «деминерализованной». Что это означает? Относят ли такую воду к полностью очищенной? 7-10. Проанализируйте методики очистки воды дистилляцией и ионным обменом. Сделайте вывод об ожидаемой степени очищенности воды. 7-11. Явление осмоса. Какую роль выполняют при этом полупроницаемые мембраны? Почему они так называются? 7-12. Механизмы перехода воды через полупроницаемые мембраны. Какие гипотезы известны? 7-13. Виды баромембранных методов и характеристики используемых мембран. 7-14. Какие современные методы очистки воды, использующие мембранные технологии, известны? Почему им дано название «баромембранные методы»? 7-15. Опишите явления «осмос» и «обратный осмос». Почему технология обратного осмоса активно используется для деминерализации воды? 7-16. Ионообменные мембраны как основной элемент электромембранных технологий. Особенности строения, обеспечивающие высокую электропроводность и селективность мембран. 7-17. Возможности методов электрофлотации и электрофореза по удалению коллоидных примесей из воды. 7-18. Опишите процесс электродиализа с катионообменной мембраной водного раствора хлорида натрия. Суммарная реакция имеет вид:
Объясните, как должен быть устроен аппарат? 7-19. Как, используя электродиализ с биполярной мембраной, осуществить получение нитрата калия по реакции:
NaNO3 + KCl → NaCl + KNO3 ?
7-20. Опишите процессы, происходящие под действием постоянного электрического тока в водном растворе сульфата натрия: а) без мембраны (процесс электролиза); б) с биполярной мембраной (процесс электродиализа). 7-21. Какую массу и каких реагентов нужно затратить на умягчение 30 л воды, имеющей средние величины жесткости: Жк = 4 ммоль экв/л, Жо = 5 ммоль экв/л. Составьте уравнения процессов умягчения воды. 7-22. Какую массу и каких реагентов нужно затратить на умягчение 7 л воды, имеющей средние величины жесткости: Жк = 1,6 ммоль экв/л, Жо = 2,75 ммоль экв/л. Составьте уравнения процессов умягчения воды. 7-23. На умягчение 10 л воды израсходовано Са(ОН)2 массой 3,7 г и Na2СО3 массой 1,06 г. Рассчитайте общую жесткость Жо исходной воды. Составьте уравнения процессов умягчения воды. 7-24. На умягчение 150 л воды израсходовано Са(ОН)2 массой 5,57 г и Na2СО3 массой 26,6 г. Рассчитайте общую жесткость Жо исходной воды. Составьте уравнения процессов умягчения воды. 7-25. При термическом умягчении 10 л воды образовался осадок массой 2 г. Определите остаточную Жнк, если исходная общая жесткость воды Жо составляла 6,5 ммоль экв/л. Составьте уравнение процесса умягчения воды. 7-26. При термическом умягчении 20 л воды образовался осадок массой 2 г. Определите остаточную Жнк, если исходная общая жесткость воды Жо составляла 5 ммоль экв/л. Составьте уравнение процесса умягчения воды. 7-27. Рассчитайте массу гидразина N2H4, которую нужно ввести для обескислороживания 1 м3 воды, содержащей 64 мг/л кислорода, если в воду предварительно было введено 126 мг/л сульфита натрия Na2SO3. Составьте уравнения процессов. 7-28. Рассчитайте массу гидразина N2H4, которую нужно ввести для обескислороживания 20 м3, содержащей 32 мг/л кислорода, если в воду предварительно было введено 63 мг/л сульфита натрия Na2SO3. Составьте уравнения процессов. 7-29. Определите, сколько литров 2 М раствора сульфита натрия Na2SO3 необходимо израсходовать для восстановления кислорода, растворенного в 50 м3 питательной воды, содержащей 3,2 мг/л О2. 7-30. Определите, сколько литров 1 М раствора сульфита натрия Na2SO3 необходимо израсходовать для восстановления кислорода, растворенного в 500 м3 питательной воды, содержащей 0,4 мг/л О2. 7-31. Определите, сколько литров 1,5 М раствора гидразина N2H4 необходимо израсходовать для восстановления кислорода, растворенного в 50 м3 питательной воды, содержащей 3,2 мг/л О2. 7-32. Определите, сколько литров 1 М раствора гидразина N2H4 необходимо израсходовать для восстановления кислорода, растворенного в 325 м3 питательной воды, содержащей 0,64 мг/л О2. |
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 870. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |