
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Термодинамика реальных систем. Термодинамика процессов комплексообразования. Комплексоны
Примеры решения задач Вычислите концентрации ионов в растворе комплексной соли по константе нестойкости комплексного иона Пример 1.Константа нестойкости Кн = 1∙10 −21. Вычислите концентрацию ионов серебра в 0,01 М раствора K[Ag(CN)2], содержащем, кроме того, 0,05 М NaCN в 1 л раствора. Степень диссоциации K[Ag(CN)2] принять равной 1моль. Решение.
так как [Ag(CN)2]− = Ag+ + 2 CN−;
NaCN = Na+ + CN−.
Избыточное количество ионов CN− сильно смещает равновесие диссоциации комплексного иона влево, поэтому концентрацией ионов CN−, получающихся в результате диссоциации комплексного иона, можно пренебречь и считать с(CN−)= 0,05 моль/л. Комплексная соль диссоциирует:
K[Ag(CN)2]
Концентрация комплексного иона:
Зная значение Кн и концентрации комплексного иона [Ag(CN)2]− и CN−, определяем концентрацию ионов серебра:
Пример 2.Вычислите концентрацию ионов серебра (I) в 0,1 М растворе [Ag(NH3)2]Cl, содержащем аммиак NH3 в концентрации 0,5 моль/л. Решение. Диссоциация комплексного соединения на ионы внешней сферы и комплексный ион необратима: [Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl−.
Запишем процесс, в котором образуются ионы серебра:
[Ag(NH3)2]+
В присутствии избытка аммиака равновесие диссоциации комплексных ионов смещено в сторону исходных и отличием равновесной концентрации комплексных частиц, оставшихся недиссоциированными, от общей концентрации комплексной соли можно пренебречь: [[Ag(NH3)2]+] = 0,1 моль/л. Константа равновесия процесса диссоциации комплексного иона, то есть константа нестойкости (Кн), обратна общей константе устойчивости комплекса β = 1,7∙107: 
Кн = [Ag+ ] [NH3]2 / [[Ag(NH3)2]+] = 1/ 1,7∙107 = 5,9∙10 −8.
Концентрация аммиака 0,5 моль/л в исходном растворе позволяет не учитывать вклад аммиака, образующегося при диссоциации комплексного иона: Кн = [Ag+ ] ∙ 0,52/ 0,1, тогда [Ag+ ] = Кн ∙ 0,1 / 0,52 = 2,3∙10 −8 моль/л.
Ответ: [Ag+ ] = 2,3∙10 −8 моль/л.
Определение возможности диссоциации комплексного иона по изменению энергии Гиббса процесса диссоциации
Пример 3.Константа нестойкости комплексного иона [Cd(CN)4]2− равна 7,66∙10 −18 при 25 °С. Вычислите ∆G0 процесса
[Cd(CN)4]2− Решение.Изменение энергии Гиббса реакции связано с константой нестойкости соотношением ∆G0 = −2,303∙R∙T∙ lg Kн.
Вычисляем ∆G0 для процесса диссоциации комплексного иона [Cd(CN)4]2−: ∆G0 = −2,303∙8,3144∙298∙ lg 7,66∙10 −18 = 97,7 кДж/моль.
Положительное значение ∆G0 свидетельствует о малой диссоциации комплексного иона [Cd(CN)4]2−.
Определение возможности разрушения комплексного иона при добавлении электролита по значению Кн комплексного иона и ПР малорастворимого соединения Пример 4. Произойдет ли образование осадка Cu(OH)2 при сливании равных объемов 1,0 М растворов КОН и [Cu(NH3)4]Cl2, содержащего избыток 0,5 моль аммиака: Кн = 9,33∙10 −13 , ПР(Cu(OH)2) = 5,6∙10 −20; степень диссоциации [Cu(NH3)4]Cl2 и КОН принять равной 1. Решение. При сливании равных объемов растворов концентрация каждого из компонентов уменьшится в 2 раза, то есть станет равной: с([Cu(NH3)4]Cl2) = 0,5 моль/л, с(КОН) = 0,5 моль/л, с(NH3) = 0,25 моль/л. В присутствии избытка аммиака равновесие диссоциации иона сильно смещено влево:
[Cu(NH3)4]2−
поэтому концентрацией аммиака, получающегося при диссоциации этого иона, можно пренебречь, а концентрацию аммиака в растворе можно считать равной 0,25 моль/л. Отсюда
Так как раствор гидроксида калия – сильный электролит
КОН = К+ + ОН−,
то с(К+) = с(ОН−) = 0,5 моль/л. Тогда
Следовательно:
осадок Cu(OH)2 образуется.
Контрольные задания
2-1. Вычислите концентрацию ионов Cd2+ в 0,1 М растворе [Cd(NH3)4]SO4. Кн[Cd(NH3)4]2+ = 2,75∙10−7. 2-2. Вычислите концентрацию ионов Ag+ в 0,1 н. растворе K[Ag(CN)2]. Кн[Ag(CN)2]− = 1,0∙10−21. 2-3. Концентрация каждого из комплексных ионов, [Cd(CN)4]2−,[Ag(CN)2]−, [Au(CN)2]−, в растворе соответствующей соли составляет 0,1 моль/л. В каком растворе концентрация цианид-ионов наименьшая? Кн[Ag(CN)2]2− = 1,0∙10−21; Кн[Cd(CN)2]2− = 7,66∙10−18; Кн[Au(CN)2]2− = 2,0∙10−38. 2-4. Рассчитайте концентрации всех частиц, присутствующих в 0,1 М растворе [Ni(NH3)6]SO4 в растворе, содержащем аммиак NH3 (концентрация 2 моль/л). Кн[Ni(NH3)6]2+ = 9,77∙10−9. 2-5. Рассчитайте концентрации всех частиц в 0,01 М растворе K[Al(OH)4] в растворе, содержащем гидроксид калия (концентрация 0,5 моль/л). Кн[Al(OH)4]− = 5,89∙10−8. 2-6. Рассчитайте концентрации всех частиц в 0,05 М растворе [Ag(NH3)2]Cl в растворе, содержащем аммиак NH3 (концентрация 0,2 моль/л). Кн[Al(OH)4]2+ = 5,89∙10−8. 2-7. Рассчитайте концентрации всех частиц в 0,5 М растворе K[Ag(CN)2] в растворе, содержащем цианид калия КСN (концентрация 0,2 моль/л). Кн[Ag(CN)2]− = 1,0∙10−21. 2-8. Вычислите концентрацию ионов меди в 0,1 М растворе [Cu(NH3)4]Cl2, содержащем аммиак NH3 в концентрации 6 моль/л. Кн[Cu(NH3)4]2+ = 9,33∙10−13. 2-9. Вычислите концентрацию ионов железа в 0,01 М растворе K3[Fe(CN)6], содержащем цианид калия KCN в концентрации 1 моль/л. Кн[Fe(CN)6]3− = 1∙10−31.
2-10. Вычислите концентрацию ионов серебра в 0,1 М растворе [Ag(NH3)2]Cl. Раствор соли содержит 5 г/л NH3. Кн[Ag(NH3)2]+ = 5,89∙10−8. 2-11. Константа нестойкости иона [CdI4]2− составляет 7,94∙10−7. Вычислите концентрацию ионов кадмия в 0,1 М растворе К2[CdI4], содержащем 0,1 моль KI в 1 л раствора. 2-12. Исходя из константы нестойкости комплекса [Zn(OH)4]2−, рассчитайте значение ∆G0 реакции диссоциации данного комплексного иона и определите, в какую сторону смещено равновесие в стандартных условиях. (Кн[Zn(OH)4]2− = 7,08∙10−16). 2-13. Исходя из константы нестойкости комплекса [Co(NH3)6]2+, рассчитайте значение ∆G0 реакции диссоциации данного комплексного иона и определите, в какую сторону смещено равновесие в стандартных условиях (Кн[Co(NH3)6]2+ = 4,07∙10−5). 2-14. Исходя из константы нестойкости комплекса [Ni(NH3)4]2+, рассчитайте значение ∆G0 реакции диссоциации данного комплексного иона и определите, в какую сторону смещено равновесие в стандартных условиях (Кн[Ni(NH3)4]2+= 9,77∙10−9). 2-15. Исходя из константы нестойкости комплекса [Fe(CN)6]3−, рассчитайте значение ∆G0 реакции диссоциации данного комплексного иона и определите, в какую сторону смещено равновесие в стандартных условиях (Кн[Fe(CN)6]3− = 1,0∙10−31). 2-16. Изменение энергии Гиббса для процесса
[Fe(СN)6]4− при 25 °С равно 137 кДж/моль. Вычислите Кн этого комплексного иона. 2-17. Изменение энергии Гиббса для процесса
[Ag(S2O3)2]3−
при 25 °С равно 98 кДж/моль. Вычислите Кн этого комплексного иона. 2-18. Изменение энергии Гиббса для процесса
[Hg(СN)4]2−
при 25 °С равно 236,9 кДж/моль. Вычислите Кн этого комплексного иона. 2-19. Образуется ли осадок PbS, если смешать равные объемы растворов: 0,1 М Na2S и 0,1 М Na2[Pb(OH)4] ? ПР(PbS) = 8,7∙10−29; Кн[Pb(OH)4]2− = 8,3∙10−13. 2-20. Образуется ли осадок PbI2, если смешать равные объемы растворов: 0,1 М KI и 0,1 М K2[Pb(OH)4]? ПР(PbS) = 8,7∙10−9; Кн[Pb(OH)4]2− = 8,3∙10−13. 2-21. Произойдет ли образование осадка карбоната цинка, если к 0,005 М раствору [Zn(NH3)4](NO3)2, содержащему 0,05 моль NH3, прибавить равный объем 0,001 М раствор К2СО3? ПР(ZnСО3) = 6∙10−11; Кн[Zn(NH3)4]2+ = 2,0∙10−11. 2-22. Будет ли выпадать осадок хлорида серебра при смешивании равных объемов 0,02 н. растворов хлорида калия и нитрата диамминсеребра? ПР(AgCl) = 1,56∙10−10; Кн[Ag(NH3)2]+ = 5,89∙10−8. 2-23. Будет ли выпадать осадок сульфида меди (II) при добавлении к 200 мл 0,01 М раствора K2[Cu(CN)4] 300 мл 0,1 М раствора сульфида калия? ПР(CuS) = 4,0∙10−38; Кн[Cu(CN)4]+ = 5,13∙10−31. 2-24. При какой концентрации ионов S2− произойдет выпадение осадка FeS из 0,003 М раствора К4[Fe(CN)6], содержащего 0,01 моль KCN в 2 л раствора? ПР(FeS) = 3,7∙10−19; Кн[Fe(CN)6]4− = 1,0∙10−24. 2-25. Произойдет ли образование осадка карбоната кадмия, если к 2 л 0,05 М раствора К2[Cd(CN)4], содержащего 0,6 моль KCN, добавить 1 л 0,03 М раствора К2СО3? ПР(CdСО3) = 2,5∙10−14; Кн[Cd(CN)4]2− = 7,66∙10−18. Растворы электролитов
Примеры решения задач
Пример 1. Рассчитайте рН 0,002 М раствора Н2СО3. Решение. Для вычисления рН растворов слабых электролитов используют формулу: pH = − lg[H+]
и учитывают первую ступень диссоциации:
Н2СО3
Равновесную концентрацию ионов водорода H+ можно вычислить двумя способами: 1. Исходя из выражения для константы диссоциации. Если принять концентрацию диссоциированных молекул Н2СО3 за с (моль/л), то в соответствии с уравнением диссоциации равновесные концентрации [Н+] = [НСО
Решением этого уравнения является с = [H+] = 3∙10−5моль/л. Следовательно, рН = 4,52. 2. Исходя из степени диссоциации: Поскольку Кд < 10−4, то в данном случае можно воспользоваться упрощенным уравнением Оствальда:
В соответствии с уравнением диссоциации концентрация ионов водорода Н+ равна концентрации НСО По определению степень диссоциации Второй способ решения позволяет избежать решения квадратного уравнения и получить дополнительную характеристику раствора – степень диссоциации (α).
Пример 2. Рассчитайте рН 0,03 М серной кислоты. Решение. Серная кислота (Н2SО4) – сильная двухосновная кислота, поэтому для расчета рН сильных электролитов используется строгая формула:
где а = γ ∙ [H+]. Коэффициент активности (γ) является функцией ионной силы раствора I и может быть определен по правилу ионной силы, согласно которому коэффициенты активности ионов одинакового заряда в растворах с одинаковой ионной силой равны по величине. Сильные электролиты в растворе или расплаве полностью распадаются на ионы, и уравнение диссоциации записывается как необратимый процесс
Н2SО4
Согласно уравнению, при полном распаде на ионы концентрация SО
Коэффициенты активности – табличные данные. В таблице 1 имеются значения коэффициентов активности при I = 0,05 и I = 0,1. Значения γ для I = 0,09 определяются методом интерполяции, допуская линейную зависимость γ от I в данном интервале. Таким образом, для I = 0,09, γ = 0,847. Откуда рН = −lg a = −lg 0,847 ∙ 0,06 = 1,3. Пример 3. Рассчитайте рН природной воды, если в 10 л растворено 11,2 л СО2 (н.у.). Решение. При растворении СО2 в воде образуется раствор угольной кислоты Н2О + СО2 = Н2СО3. Рассчитаем начальную концентрацию (с0) полученного раствора. Известно, что при нормальных условиях (н.у.) 1 моль любого газа занимает объем 22,4 л. Следовательно, концентрацию СО2 в воде и концентрацию Н2СО3 можно рассчитать из соотношения:
где Vв– объем воды, Vг − объем СО2. Подставляя числовые значения, получаем:
Угольная кислота является слабым электролитом и диссоциирует в воде по двум ступеням: Н2СО3 = Н+ + НСО
НСО
Константа диссоциации Кд1>Кд2, поэтому рН полученного раствора рассчитываем по первой ступени диссоциации. Степень диссоциации
Концентрация ионов в растворе при растворении в воде углекислого газа [H+] = α∙с0 = 3∙10−3 ∙5∙10−2 = 1,5∙10−4 моль/л.
Определим рН полученного раствора:
pH = − lg[H+] = − lg1,5∙10−4 = 3,8.
По величине рН можно сделать вывод, что при растворении в воде углекислого газа получается раствор с кислой реакцией среды. Таблица 2 |
||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 1961. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 К+ + [Ag(CN)2]−.
К+ + [Ag(CN)2]−.

 Ag+ + 2NH3.
Ag+ + 2NH3.


 > ПР(Cu(OH)2),
> ПР(Cu(OH)2), Н+ + НСО
Н+ + НСО  ; Кд = 4,47∙10−7.
; Кд = 4,47∙10−7.

 Тогда, концентрация ионов водорода [H+] = α∙с0 = 1,49∙10−2 ∙2∙10−3 = 3∙10−5моль/л. Искомое значение рН = −lg 3∙10−5 = 4,52.
Тогда, концентрация ионов водорода [H+] = α∙с0 = 1,49∙10−2 ∙2∙10−3 = 3∙10−5моль/л. Искомое значение рН = −lg 3∙10−5 = 4,52.
 ,
, 2Н+ + SО
2Н+ + SО  .
.
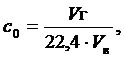

 ; Кд1 = 4,45∙10−7.
; Кд1 = 4,45∙10−7. = Н+ + СО
= Н+ + СО  ; Кд2 = 4,69∙10−11.
; Кд2 = 4,69∙10−11.