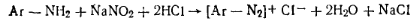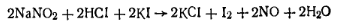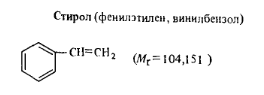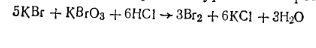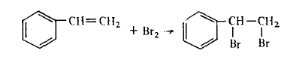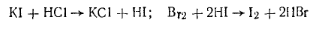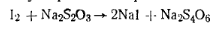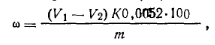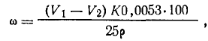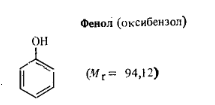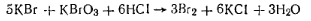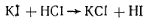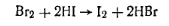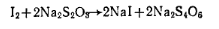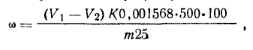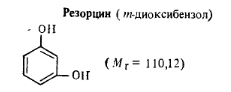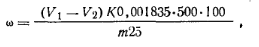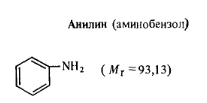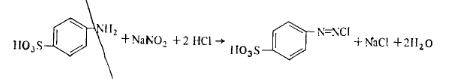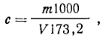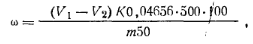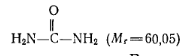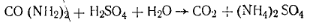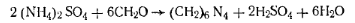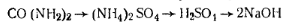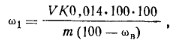Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Работа 10. Определение содержания ацетальдегидаПриготовление реактива. В 200 мл этилового спирта растворяют 1 г солянокислого гидроксиламина, затем добавляют несколько капель 0,1 %-иого раствора метилового оранжевого. Цвет реактива доводят до оранжевого добавлением по каплям раствора соляной кислоты. Реактив может храниться длительное время. Ход определения. Для проведения пробы на альдегид помещают 5 мл реактива в пробирку, прибавляют 1 мл испытуемого винилацетата, взбалтывают и через 1 мин сравнивают с цветом реактива до прибавления пробы. При отсутствии аце-тальдегида не должно происходить изменения цвета. При содержании в пробе уже 0,05% альдегида жидкость краснеет.
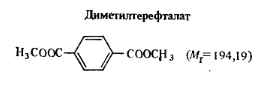
Диметиловый эфир терефталевой кислоты — белый кристаллический порошок. В промышленности его получают окислением л-ксилола. Применяют в производстве полиэтилентерефталата. В соответствии с ГОСТ 11363—80 продукт контролируется по массовой доле основного вещества (не менее 99, 96%), кислотному числу (0,03), температуре кристаллизации (140,6°С), числу омыления (578плюс минус 2).
ПРОИЗВОДНЫЕ БЕНЗОЛА
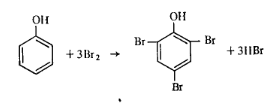
В промышленности пластмасс нашли применение различные производные бензола: фенолы, анилин, стирол. Поскольку эти соединения содержат различные функциональные группы, для их количественного определения предложено множество способов. В техническом анализе преимущественное значение получили методы бромирования и диазотирования. Метод бромирования позволяет определять содержание непредельных ароматических соединений, фенолов, ароматических аминов. При бромировании непредельных соединений элементарный бром присоединяется по месту разрыва двойных связей.  При количественном определении фенолов и ароматических аминов свободный бром замещает водород бензольного ядра. Окси-группа и аминогруппа (заместители первого рода) увеличивают подвижность атомов водорода бензольного ядра, стоящих в орто-и пара-положениях:
Бромирование орто-и пара- замещенных фенолов происходит с образованием дигалогенозамещенных:
Мета-замещенные фенолы образуют трибромзамещенные производные:
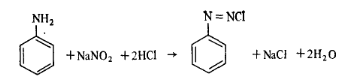
Таким образом, на бромирование 1 моль орто-и пара-замещенного фенола расходуется 2 моль брома, а на 1 моль фенола или его мета-замещенного — 3 моль брома. Метод диазотирования используют для количественного определения ароматических аминов. Для первичных ароматических аминов характерна реакция с азотной кислотой, в результате которой образуются диазосоединения (соли диазония). Так как азотистая кислота — вещество нестойкое, то применяют ее соли в среде минеральной кислоты. Реакция протекает по схеме
В качестве титрованного раствора применяют раствор нитрита натрия. Конец диазотирования определяют по иодкрахмальной бумаге в качестве индикатора. Капля избыточной азотистой кислоты, нанесенная на индикатор, окисляет иодид-ион до иода. Иод, реагируя с крахмалом, окрашивает индикатор в синий цвет:
Реакция диазотирования ведется при низкой температуре, так как азотистая кислота, которая выделяется при взаимодействии минеральной кислоты с нитритом натрия, нестойкая и при более высокой температуре разлагается. Кроме того, образующиеся в результате реакции соли диазония при более высокой температуре разлагаются с выделением азота. Для проведения диазотирования необходим избыток минеральной кислоты по сравнению с теоретически рассчитанным количеством, так как в кислой среде получаются более стойкие диазосоединения. Для ускорения процесса диазотирования к кислотному раствору добавляют небольшое количество бромида калия.
Бесцветная прозрачная жидкость со специфическим запахом. Растворяется во многих органических растворителях, в воде практически не растворим. Технические требования к качеству стирола (ГОСТ 10003—76) приведены в табл. 7. В промышленности его получают дегидрированием этилбензола. Применяется для получения гомополимера и сополимеров стирола. Стирол легко воспламеняется. Пары стирола действуют на нервную систему, раздражают слизистые оболочки.
Работа 1. Определение массовой доли стирола. В заводском аналитическом контроле часто используют метод бромирования стирола. Бромируют стирол в кислой среде бромид-броматным раствором. В кислой среде бромид-броматная смесь выделяет свободный бром по уравнению реакции
Бром присоединяется по месту разрыва двойных связей:
Избыток брома, не вступивший в реакцию со стиролом, реагирует с иодистоводородной кислотой с выделением свободного иода. Иодистоводородная кислота выделяется из иодида калия в кислой среде:
Иод титруют тиосульфатом натрия:
Молярная масса эквивалента стирола равна 1/2 массы его моля. Данный метод не совсем точен, так как могут бромироваться примеси непредельных соединений, находящиеся в продукте.
Реактивы и оборудование
Крахмал растворимый, 0,5%-ный раствор Этиловый спирт Бромид-броматный, 0,1 и. раствор (приготовление см. разд. 8.3, работа 7) Соляная кислота, р=1,19 Иодид калия, 10 %-ный раствор Бюкс для взятия навески Колба коническая па 250 мл с пришлифованной пробкой Пипетка па 50 мл Цилиндр мерный на 25 мл Тиосульфат натрия, 0,1 н. раствор
Ход определения. Навеску стирола ~0,15—0,2 г взвешивают в бюксе с точностью до 0,0002 г, растворяют в 5 мл этилового спирта и переносят в коническую колбу емкостью 250 мл с притертой пробкой. Бюкс ополаскивают еще 5 мл этилового спирта и присоединяют к раствору. Затем в колбу приливают пипеткой 50 мл 0,1 н. бромид-броматного раствора, 10 мл концентрированной соляной кислоты и, быстро закрыв колбу пробкой, перемешивают. По истечении 30 мин в колбу быстро вливают из мерного цилиндра 10—15 мл 10%-ного водного раствора иодида калия и выделившийся свободный иод оттитровывают 0,1 н. раствором тиосульфата натрия. В качестве индикатора используют 0,5%-ный раствор крахмала, который добавляют в конце титрования, когда цвет раствора станет соломенно-желтым. Параллельно в тех же условиях ставят контрольный опыт. Массовую долю стирола в ω (%) вычисляют по формуле
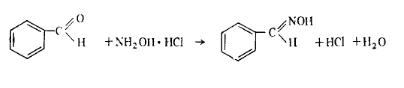
где V1— объем 0,1 н. раствора тиосульфата натрия, затраченный на титрование в контрольном опыте; V2— объем 0,1 н.раствора тиосульфата натрия, затраченный на титрование в основном опыте; К — коэффициент поправки для 0,1 н. раствора тиосульфата натрия; 0,0052 — масса стирола, соответствующая 1 см3 точно 0,1 н. раствора тиосульфата натрия, г; m — масса навески стирола, г. Работа 2. Определение массовой доли карбонильных соединений. Массовую долю альдегидов определяют гидроксилами-новым методом. Расчет ведут на бензальдегид:
Реактивы и оборудование Метиловый спирт Тимоловый синий, 0,1%-ный раствор Гидроксид натрия, 0,05 и. раствор Пипетка на 25 мл Гидроксиламин солянокислый Колба коническая на 250 мл с при- шлифованной пробкой
Ход определения. 25 мл стирола отмеряют пипеткой с грушей в коническую колбу емкостью 250 мл с притертой пробкой, куда предварительно помещают 25 мл метилового спирта. Затем прибавляют 8 — 10 капель 0,1%-ного раствора индикатора тимолового синего и нейтрализуют 0,05 н. раствором гидроксида натрия до красно-желтой окраски. Прибавляют пипеткой 25 мл нейтрализованного раствора солянокислого гидроксиламина в метиловом спирте (20 г гидроксиламина в 1 л метилового спирта) и оставляют стоять в течение 1 ч, изредка взбалтывая. После этого выделившуюся кислоту оттитровывают 0,05 н. раствором гидроксида натрия до красно-желтой окраски. Одновременно в тех же условиях проводят контрольный опыт. Массовую долю альдегидов ω (%) в пересчете на бензальдегид вычисляют по формуле где V1 — объем 0,05 н. раствора гидроксида натрия, пошедший на титрование в контрольном опыте; V2 — объем 0,05 н. раствора гидроксида натрия, пошедший на титрование в основном опыте; K — коэффициент поправки для 0,05 н. раствора гидроксида натрия; 0,0053 — масса бензальдегида, соответствующая 1 см3 точно 0,05 н. раствора гидроксида натрия, г; р — плотность стирола (0,906 г/см3).
Работа 3. Определение наличия полимера. Полимер в стироле определяют добавлением к 5 мл стирола 25 мл этилового спирта. В присутствии полимера происходит помутнение раствора. Содержание полимера можно определить рефрактометрически, пользуясь табл. 6 приложения. Работа 4. Определение оптической плотности. Оптическую плотность стирола определяют спектрофотометрически на кварцевом спектрофотометре СФ-4 (или СФ-4А) в прямоугольных кнарцевых кюветах, как правило, с толщиной слоя жидкости 5 мм. Ход определения. Кварцевые кюветы дважды промывают спиртом и высушивают на воздухе или в термостате. Чистые кюветы в собранном виде устанавливают в оправу спектрофотометра и производят отсчет их оптической плотности по отношению друг к другу для длины волны 313 нм. Для определения светопропускаемости одну кювету заполняют испытуемым стиролом, другую оставляют пустой. Обе кюветы устанавливают в оправу спектрофотометра и определяют оптическую плотность испытуемого образца при длине волны 313 нм и толщине слоя 5 мм.
Оптическую плотность D0вычисляют по формуле D0= =О0' — 0,195, где D0' — оптическая плотность образца, измеренная по отношению к пустой кювете; 0,195 — оптическая плотность контрольного образца по отношению к пустой кювете для толщины слоя 5 мм.
Бесцветные или слабо-розовые кристаллы с характерным запахом. В воде растворим ограниченно, растворим в бензоле, растворах щелочей. Ядовит. Существует много промышленных способов получения фенола. В последнее время наибольшее распространение получил синтез фенола совместно с ацетоном через изопропилбензол. Применяется в производстве фенолоальдегидных смол. Технические требования (по ГОСТ 236—68): массовая доля фенола в техническом продукте не менее 98—99,9%; температура кристаллизации не ниже 40,4°С; растворимость в воде при 20°С не менее 8 г в 100 мл воды.
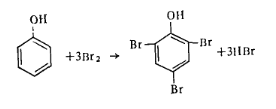
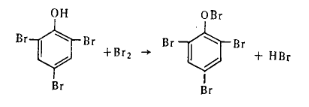
Работа 5. Определение массовой доли фенола. В заводской практике наибольшее распространение получил метод бромирования, основанный на том, что фенол в водном растворе количественно образует с бромом трибромфенол. Бромируют фенол свободным бромом, который выделяется избромид броматного раствора в кислой среде:
Фенол, реагируя с бромом, количественно переходит вначале в трибромфенол:
а затем при избытке брома — в трибромфенолбром:
Прибавляемый иодид калия в кислом растворе выделяет иодистоводородную кислоту:
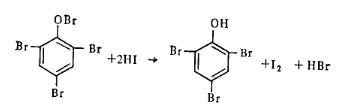
Под действием иодистоводородной кислоты трибромфенолбром снова переходит в трибромфенол и не мешает количественному определению фенола данным методом:
Избыток брома, не вступивший в реакцию с фенолом, реагирует с иодистоводородной кислотой с выделением свободного иода:
Иод титруют тиосульфатом натрия:
Из сопоставления веществ, участвующих в реакциях, видно, что на 1 моль фенола расходуется 6 молярных масс эквивалентов брома, иода или тиосульфата. Отсюда молярная масса эквивалента фенола равна 1/6 массы моля, т. е. 15,67 г. Данной метод применим только для определения фенола при отсутствии примесей, способных бромироваться.
Реактивы и оборудование Бромид-броматый, 0,1 н. раствор Бюкс для взятия навески (приготовление см. разд. 8.3, рабо- Колба мерная на 500 мл та 7) \ Пипетка на 25 и 50 мл Соляная кислота,\р= 1,19 Колба коническая на 250 мл с Иодид калия, 10%-ный раствор пришлифованной пробкой Тиосульфат натрия. 0,1 н. раствор Цилиндр мерный на 25 мл Крахмал растворимый, 1%-ный раствор
Ход определения. Навеску фенола ~1 г, взятую с точностью до 0,р02 г, помещают в мерную колбу емкостью 500 мл, растворяют в дистиллированной воде и доводят водой до метки. На одно определение отбирают пипеткой 25 мл этого раствора в колбу с притертой пробкой емкостью 250 мл, прибавляют пипеткой 50 мл 0,1 н. раствор бромид-броматной смеси и 10 мл концентрированной соляной кислоты. Раствор перемешивают и оставляют на 20 мин в темном месте. После этого к смеси прибавляют 15 мл 10%-ного водного раствора иодида калия, оставляют на 15 мин в темном месте и выделившийся иод титруют 0,1 н. раствором тиосульфата натрия. В конце титрования, когда цвет раствора станет соломенно-желтым, добавляют несколько капель 1%-ного раствора крахмала в качестве индикатора и титруют до исчезновения голубой окраски. Параллельно ставят контрольный опыт в тех же условиях с теми же реактивами, но вместо раствора фенола берут 25 мл дистиллированной воды. Массовую долю фенола ω (%) рассчитывают по формуле где v1— объем 0,1 н. раствора тиосульфата натрия, израсходованный на титрование в контрольном опыте; v2— объем 0,1 н. раствора тиосульфата натрия, израсходованный на титрование в основном опыте; К. — коэффициент поправки для 0,1 раствора тиосульфата натрия; 0,001568 — масса фенола, соответствующая 1 см3 точно 0,1 н. раствора тиосульфата натрия, г; m — масса навески фенола.
Бесцветные кристаллы со слабым специфическим запахом и сладковатым жгучим вкусом, краснеет от действия света и влаги.
Массовая доля основного вещества (по ГОСТ 9970 — 74) 99,5%, температура кристаллизации 109,2°С.
Работа 6. Определение массовой доли резорцина. Для количественного определения резорцина используют метод бромирования. Реакции, проходящие в процессе анализа, описание методики определения и обозначение величин в расчетной формуле даны при анализе фенола (разд. 8.4, работа 5). Массовую долю резорцина ω (%) рассчитывают по формуле где 0,001835 — масса резорцина, соответствующая 1 см3 точно 0,1 н. раствора тиосульфата натрия, г.
Маслянистая прозрачная жидкость светло-желтого цвета. При стоянии окисляется кислородом воздуха, изменяя свой цвет до коричневого. Технические требования по ГОСТ 313—77: массовая доля анилина в высушенном продукте не менее 99,8%; влаги не более 0,1%; нитробензола не более 0,001%; температура кристаллизации не ниже — 6,5°С.
Работа 7. Определение массовой доли анилина.Количественное определение содержания анилина ведется методом диазотирования:
Реактивы и оборудование Бюкс для взятия навески Колба мерная иа 500 мл Пипетка на 50 мл Стакан химический на 300 мл Соляная кислота, р = 01,19 Соляная кислота, 10%-ный раствор Бромид калия Нитрит натрия, 0,5 н. раствор Иодокрахмальная бумага
Приготовление реактивов. 1. Приготовление иодокрахмальной бумаги: 1 г крахмала смешивают с 5, мл воды и смесь медленно вливают при постоянном перемешивании в 100 мл кипящей дистиллироваииой воды. Кипятят в течение 2—3 мин и охлаждают. Затем к раствору добавляют 0,5 г. иодида калия. Этим раствором пропитывают беззольную фильтровальную бумагу, сушат ее при комнатной температуре в темном месте и нарезают на кусочки нужных размеров. Хранят иодкрахмальную бумагу в банке оранжевого стекла с притертой пробкой в темном месте. 2. Приготовление 1 н. раствора нитрита натрия и установление его титра: 70 г чистого кристаллического нитрита натрия растворяют вдистиллированной вода в мерной колбе емкостью 1000 мл и доводят объем водой до метки. Титр приготовленного раствора устанавливают по навеске сульфаниловой кислоты:
Навеску очищенной сульфаниловой кислоты 4—4,5 г, взятую с точностью до 0,0002 г, помещают в стакан емкостью 1000 мл, растворяют в 200 мл дистиллированной воды, добавляют 12 мл 25%-ного раствора аммиака, разбавляют раствор водой до объема 800 мл и подкисляют 20 мл концентрированной соляной кислоты. Охлаждают во льду до температуры не выше +10° и титруют приготовленным раствором нитрита натрия. Титрование считают законченным, если после выдержки в течение 3 мин капля раствора, нанесенная на иодкрахмальную бумагу, будет давать синее пятно. Молярную концентрацию эквивалента (нормальность) раствора NaNО2 вычисляют но формуле
где т — масса навески сульфаниловой кислоты; 173,2 — молярная масса эквивалента сульфаниловой кислоты, г; V— объем раствора нитрита натрия, израсходованного на титрование. Очистку сульфаниловой кислоты производят методом перекристаллизации. Для этого сульфаниловую кислоту дважды перекристаллизовывают из кипящей воды, фильтруют и сушат до постоянной массы в сушильном шкафу при температуре 120°С. 0,5 н. растворNaNO2 готовят разбавлением 1 н. раствора нитрита натрия. Примечание. При работе с йодкрахмалыюй бумагой следует иметь в виду, что синее пятно на бумаге может образоваться и в отсутствие нитрит-иона за счет окисления иодид-иона кислородом воздуха в среде сильной кислоты. Нитрит-ион дает пятно ярко-синего цвета с фиолетовым ободком, а пятно от кислоты имеет фиолетовый оттенок, бурый по краям. Ход определения. Перед определением анилин сушат над расплавленным гидроксидом натрия или калия в течение 12 ч и фильтруют. Навеску ~10 г сухого анилина взвешивают в бюксе и количественно переводят в мерную колбу емкостью 500 мл, смывая бюкс 25 мл концентрированной соляной кислоты; объем колбы доводят дистиллированной водой до метки. Для анализа берут пипеткой 50 мл полученного раствора, переносят в стакан емкостью 300 мл, добавляют 100 мл воды, 10 мл 10%-ной соляной кислоты, 1 г бромида калия и титруют 0,5 н. раствором нитрита натрия при температуре раствора 15—20°С. Первое титрование производят приближенно, добавляя по 5 мл нитрита натрия до появления синего пятна на иодкрахмальной бумаге. Затем титрование производят повторно для новой порции раствора, медленно приливая при перемешивании почти весь нужный объем (90%) нитрита натрия. Под конец титрования нитрит натрия добавляют по каплям и проводят пробу на иодкрахмальную бумагу после добавления каждой капли нитрита. Титрование считают законченным, если капля раствора, нанесенная на иодкрахмальную бумагу, через 3 мин после прибавления последней порции нитрита натрия дает посинение. Параллельно ставят контрольный опыт /ля определения чувствительности индикаторной бумаги. Для этого в стакан наливают все реактивы, кроме анализируемого продукта, в тех же количествах и титруют по каплям раствором нитрита натрия до появления характерного посинения иодкрахмалыюй бумаги. Массовую долю анилина ω (%) вычисляют по формуле
где v1— объем 0,5 н. раствора нитрита натрия, израсходованный на титрование пробы; V2 — объем 0,5 н. раствора нитрита натрия, израсходованный на титрование контрольного опыта (для установления чувствительности иодкрахмальной бумаги) ;К — коэффициент поправки для 0,5 н. раствора нитрита натрия; 0,04656 — масса анилина, соответствующая 1 см3 точно 0,5 н. раствора нитрата натрия, г; т — масса навески анилина.
АЗОТСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
В промышленности пластмасс из азотсодержащих соединений для синтеза полимеров и смол используют мочевину (карбамид), меламин, гексаметилендиамин, гексаметилентетрамин (уротропин), акрилонитрил, толуилендиизоцианат. Значение перечисленных соединений велико в производстве мочевино-альдегидных смол и пластических масс на их основе, в производстве полиамидов и полиуретанов. Мочевина (карбамид)
Белые кристаллы или гранулы. Растворяется в воде, метиловом спирте. В промышленности мочевину получают синтезом из аммиака и диоксида углерода. Количественное определение мочевины сводится к определению азота по Кьельдалю или по видоизмененному методу.
Работа 1. Определение массовой доли азота. Расчет ведут на азот аммонийной соли, которая, образуется в результате гидролиза мочевины
Массовую долю аммонийной соли определяют по методу Крапивина. Для этого к раствору прибавляют формалин. Образующееся при этом слабое органическое основание — гекса-метилентетрамин — не реагирует на индикатор и позволяет оттитровать выделившуюся по реакции кислоту:
Согласно соотношению веществ, участвующих в реакциях:
Молярная масса эквивалента азота равна 1/2 массы его моля.
Реактивы и оборудование Серная кислота, р=1,84 Серная кислота, 0,5 н. раствор Гидроксид натрия, 5 н. раствор Формалин, 25%-ный раствор Гидрокснд натрия, 1 н. раствор Метиловый красный, 0,1%-ный спиртовой раствор Фенолфталеин, 1%-ный спиртовой раствор Тимолфталеин, 0,1%-ный спиртовой раствор Бюкс для взятия навески Колба Кьельдаля Колба коническая на 250 мл Цилиндр мерный на 50 мл
Ход определения. Навеску мочевины ~1 г, взятую с точностью до 0,0002 г, вносят в круглодонную колбу с длинным горлом (колбу Кьельдаля, см. рис. 45, а). Остаток навески на горле колбы осторожно смывают в колбу 3—5 мл воды и прибавляют 3 мл серной кислоты. Содержимое колбы перемешивают, закрывают крышкой-колпачком и осторожно нагревают на асбестовой сетке до прекращения бурного выделения пузырьков СО2. Затем нагревание усиливают до слабого кипения жидкости и продолжают его до полного прекращения выделения отдельных пузырьков двуок-сида углерода и появления белых паров серной кислоты. Охладив раствор, добавляют 50 мл дистиллированной воды, перемешивают и переносят в коническую колбу емкостью 250 мл. Прибавляют 2—3 капли индикатора метилового красного и нейтрализуют избыток кислоты 5 н. раствором щелочи до перехода розовой окраски раствора в желтую, а затем прибавляют по каплям 0,5 н. раствор серной кислоты, до появления вновь светло-розового окрашивания. К нейтрализованному раствору прибавляют 40 мл 25%-ного раствора формалина, 5 капель смешанного индикатора (смесь равных объемов фенолфталеина и тимолфталейна) и через 1 — 2 мин титруют выделившуюся кислоту 1 н. раствором гидрок-сида натрия до появления розовой окраски раствора, не исчезающей в течение 1—2 мин. Раствор после прибавления формалина приобретает розовую окраску. По мере титрования окраска раствора переходит вначале в желтый, а затем в розовый цвет, что указывает на конец титрования. Массовую долю азота ω1 (%) в пересчете на сухое вещество вычисляют по формуле
где V— объем 1 и. раствора гидроксида натрия, пошедший на титрование; К — коэффициент поправки для 1 н. раствора гидроксида натрия; т — масса навески мочевины, г; сов — мае.доля воды 0,014 — масса азота, соответствующая 1 см3 точно 1н. раствора гидроксида натрия, г. Результаты определения можно выразить в пересчете на мочевину, умножив массовую долю азота (%) на фактор пересчета, равный 2,145.
|
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 547. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |