Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Количество вещества. Моль. Число Авогадро. Молярная масса.Моль-это количество вещества, содержащее столько структурных единиц(атомов, молекул, ионов), сколько атомов содержится в 12 г углерода. Обозначается буквой ν(ню) Зная массу атома углерода 1,993·10-26 кг можно вычислить число атомов в 0,012 кг углерода: NA=0,012/1,993·10-26=6,02·1023 Это число называется постоянной Авогодро и обозначается NA Используя эту величину можноопределить количество вещества по формуле:
Молярная масса равна отношению массы вещества к количеству вещества, обозначается буквой М.
Молярная масса рассчитывается так же как и относительная молекулярная масса, но в отличии от неё имеет размерность г/моль. Например М(H2SO4)=1·2+32+16·4=98г/моль.Это означает, что масса 1 моль серной кислоты равна 98 г.
где V-объём газа в л. Химические свойства кислорода. Кислород относится к активным неметаллам. Во всех соединениях, кроме соединений с фтором и пероксидов, он имеет степень окисления -2, (в соединениях с фтором кислород проявляет степень окисления +2, а в пероксидных соединениях степень его окисления равна -1 или даже дробному числу. Это объясняется тем, что в пероксидах 2 или несколько атомов кислорода соединены друг с другом). Кислород взаимодействует со всеми металлами, за исключением золота и платиновых металлов (кроме осмия), образуя оксиды: 2 Мg + О2 = 2 MgО (оксид магния); 4 Аl + 3 О2 = 2 Аl2O3 (оксид алюминия). Он взаимодействует также со всеми, кроме галогенов, неметаллами, образуя кислотные или несолеобразующие (индифферентные) оксиды:  S + О2 = SО2 (оксид серы (IV)); 4 Р + 5 O2 = 2 Р2О5 (оксид фосфора (V)); N2 + О2 = 2 NО (оксид азота (II)). В кислороде и на воздухе легко окисляются (сгорают или тлеют) многие неорганические и органические вещества. 2 ZnS + 3 O2 = 2 ZnО + 2 SO2; (сульфид цинка окисляется до оксида цинка и оксида серы четырехвалентной) СН4 + 2O2 = СО2 + 2Н2О; (метан окисляется до углекислого газа и воды) В атомарном состоянии кислород более активен, чем в молекулярном. Это свойство используют для отбеливания различных материалов (легче разрушаются окрашивающие органические вещества). В молекулярном состоянии кислород может существовать в виде кислорода (O2) и озона (O3), т. е. для него характерно явление аллотропии.
3. Решите задачу. Определите число молей Na2O, образовавшегося при горении 12г Na на воздухе.
Билет-8 Типы химических реакций. Химические реакции по количеству исходных веществ и продуктов реакции можно разделить на группы:
окислительно-восстановительные реакции, т.е. реакции при которых происходит изменение степеней окисления:
В этой реакции изменились степени окисления у хлора и натрия, следовательно она является окислительно - восстановительной. Натрий отдаёт электроны хлору, он является восстановителем; хлор принимает электроны, является окислителем. Процесс отдачи электронов называется окислением, процесс присоединения - восстановлением. С данными реакциями и процессами познакомимся в разделе" Окислительно-восстановительные реакции" |
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 304. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
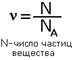
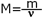
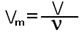
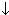 NaOH+HCl=NaCl+H2O
NaOH+HCl=NaCl+H2O