Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Физические и химические явления. Признаки химических реакций.Стр 1 из 18Следующая ⇒ Билет-1 Хлор в периодической системе. Основные соединения хлора. Физические и химические свойства. Хлор входит в подгруппа галогенов. Все элементы данной подгруппы - ярко выраженные неметаллы. В свободном состоянии галогены образуют вещества, состоящие из двухатомных молекул F2, Cl2, Br2, I2. Свойства хлора.
Получение хлора. 1.Электролиз хлоридов 2KCl Химические свойства хлора.
Применение хлора. применяют в производстве хлорсодержащих органических соединений (60-75%), неорганических веществ (10-20%), для отбелки целлюлозы и тканей (5-15%), для санитарных нужд и обеззараживания (хлорирования) воды. Натрий. Соединения натрия. На́трий — элемент главной подгруппы первой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 11. Обозначается символом Na. Атомная масса – 23. Электронная конфигурация 1s22s22p63s1 p+=11 e-=11 n0=12 Натрий — серебристо-белый металл, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Кислородное соединение натрия – Na2O (Оксид натрия) Водородное соединение натрия – NaH (гидрид натрия)  Получение натрия. Первым промышленным способом получения натрия была реакция восстановления карбоната натрия углем при нагревании: Na2CO3 + 2C → 2Na + 3CO Химические свойства натрия
СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ Щелочные металлы - самые сильные восстановители, их ионы не проявляют окислительных свойств. Гидроксиды(едкие щелочи) - твердые кристаллические вещества, типично ионные соединения, сильные основания. NaOH-едкий натр, каустическая сода Соли - типично ионные соединения, как правило-хорошо растворимы в воде, кроме некоторых солей лития. Образованные слабыми кислотами сильно гидролизуются. Na2CO3 10H2O - кристаллическая сода Na2CO3 - кальцинированная сода NaHCO3 - питьевая сода Качественные реакции: окрашивание пламени ионами Na+ - желтое 3. Допишите уравнения химических реакций, определите тип коэффициенты: Fe(N03)2 + Ca3(P04)2= Fe3(PO4)2 + Ca(NO3)2 2Na + 2Н20= 2NaOH + H2 Mg + 2HCI= MgCl2 + H2 Билет-2 Физические и химические явления. Признаки химических реакций. Существует два типа явлений природы: 1) явления, при которых молекулы веществ не изменяются – физические явления; 2) явления, при которых молекулы веществ изменяются – химические явления. Что же происходит с веществами при этих явлениях? В первом случае молекулы сталкиваются и разлетаются, не изменившись; во втором – молекулы, столкнувшись, реагируют друг с другом, при этом одни молекулы (старые) разрушаются, а другие (новые) образуются. Физические явления – явления, при которых одни химические вещества не превращаются в другие. (Существует группа физических явлений, в которых изменяются сами атомы (точнее атомные ядра) . Естественно, что при этом изменяются и вещества, образуемые этими атомами. Так происходит, например, при ядерном взрыве) При плавлении, кипении, сублимации, перетекании жидкости, изгибе твердого тела и других подобных явлениях молекулы веществ не изменяются. Химические явления (химические реакции) – явления, при которых одни химические вещества превращаются в другие Признаки физических явлений: Тепловые - изменяется температура тел, изменяется агрегатное состояние вещества, тепло переходит от одного тела к другому. Механические - тела движутся и взаимодействуют, при этом изменяется их скорость, могут измениться форма и размеры тела. Звуковые - мы воспринимаем их органом слуха, но практически все знают, что существует ультразвук, с помощью него общаются, напрмер, дельфины. Световые - мы воспринимаем их органом зрения. Магнитные и электрические - мы не можем воспринимать их органами чувств, но обнаруживаем по воздействию на другие тела и используем в повседневной жизни. Ядерные - радиация, процессы при работе атомного реактора или взрыве атомной бомбы. Действие всемирного тяготения - камни падают на Землю, Солнце удерживает около себя целую семью планет Признаки химических явлений: появление запаха, изменение цвета вещества, появление осадка, выделение газа или резкое изменение температуры при смешивании прозрачных жидкостей Физические явления: Шаровая молния, кипение воды, падение камня Химические явления: Скисание молока, гашение соды уксусом, сгорание дерева |
|||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 249. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||
 2K+ Cl2
2K+ Cl2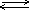 HCl + HClO(хлорная вода)
HCl + HClO(хлорная вода)