
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
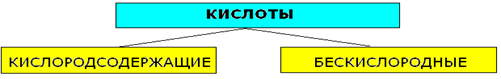
Кислоты, состав и способы их получения.Кислоты - сложные вещества, состоящие из одного или нескольких атомов водорода, способных замещаться на атома металлов, и кислотных остатков.Число атомов водорода определяет основность кислот. Классификация кислот.
Получение кислот.
Состав воды. Физические свойства. Вода состоит из двух атомов водорода и одного атома кислорода. Вода может находится в трех агрегатных состояниях – жидком, твердом и газообразном. Это жидкость без цвета, вкуса и запаха. Температура кипения – 1000С, температура замерзания – 00С. Вода – весьма активное в химическом отношении вещество. 1) Вода реагирует со многими металлами с выделением водорода: 2Na + 2H2O = H2 + 2NaOH(бурно) 3Fe + 4H2O = 4H2 + Fe3O4(только при нагревании) Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). C + H2O = H2 + CO(при сильном нагревании) CH4 + 2H2O = 4H2 + CO2(при сильном нагревании) 2) Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем:
3) Вода реагирует со многими оксидаминеметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения: SO2 + H2O → H2SO3 (сернистая кислота) 4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. Примеры таких реакций мы уже встречали:  CaO + H2O → Ca(OH)2 5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом.
3. Допишите уравнения химических реакций, определите тип реакции, расставьте коэффициенты: CuCI2+ FeSO4= CuSO4 + FeCl2 2Н2O= 2H2 + O2 2Мn + 14НСl= 2MnCl7 + 7H2 Билет-12 Соли. Состав и химические свойства солей. Соли - сложные вещества, состоящие из атомов металлов металлов (иногда входит водород) и кислотных остатков. Классификация солей.
NaHSO4 NaSO4 MgOHCl Гидросульфат Сульфат гидроксохлорид Натрия натрия магния Получение солей.
Химические свойства солей.
Химические свойства воды. Вода – весьма активное в химическом отношении вещество. 1) Вода реагирует со многими металлами с выделением водорода: 2Na + 2H2O = H2 + 2NaOH(бурно) 3Fe + 4H2O = 4H2 + Fe3O4(только при нагревании) Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). C + H2O = H2 + CO(при сильном нагревании) CH4 + 2H2O = 4H2 + CO2(при сильном нагревании) 2) Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем:
3) Вода реагирует со многими оксидаминеметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения: SO2 + H2O → H2SO3 (сернистая кислота) 4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. Примеры таких реакций мы уже встречали: CaO + H2O → Ca(OH)2 5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом.
3. Осуществите следующие превращения: Mg 1). 2Mg + O2 → 2MgO 2). MgO + H2O → Mg(OH)2 3). Mg(OH)2 + 2HCl → MgCI2 + H2O 4). MgCI2 + Ag2SO4 → MgSO4 + 2AgCl Билет-13 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 223. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
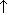 +NaHSO4
+NaHSO4
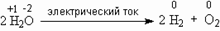
 +H2O
+H2O
 MgO
MgO