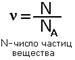Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Химические свойства кислот.Химические свойства.
Состав и классификация оснований. Основания - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами-ОН.По номенклатуре основания называют гидроксидами:
К щелочам относят гидроксиды щелочных и щелочноземельных металлов (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2.Остальные - нерастворимые. К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью-как кислоты. Получение оснований.
3. Осуществите следующие превращения: Ғе 1). 2Fe + O2 → 2FeO 2). FeO + 2HCl → FeCI2 + H2O 3). 3FeCI2 + 2K3PO4 → Fe3(PO4)2 + 6KCl Билет-14 Химические свойства оснований.
Понятие о газах. Закон Авогадро. Молярный объем газа. Относительная плотность газов. Моль-это количество вещества, содержащее столько структурных единиц(атомов, молекул, ионов), сколько атомов содержится в 12 г углерода. Обозначается буквой ν(ню) Зная массу атома углерода 1,993·10-26 кг можно вычислить число атомов в 0,012 кг углерода: NA=0,012/1,993·10-26=6,02·1023 Это число называется постоянной Авогодро и обозначается NA Используя эту величину можноопределить количество вещества по формуле:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 244. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 ҒеО
ҒеО