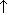Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Концентрация растворов. Массовая доля растворенного вещества.Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. В растворах соотношение количеств растворенного вещества и растворителя бывает разным. Если количество растворенного вещества по отношению к растворителю достаточно большое, то такой раствор называют концентрированным. Если же растворенного вещества мало, то такой раствор считается слабым. Масса раствора — это сумма масс растворенного вещества и растворителя. Например, если в 100 г воды растворить 10 г сахара, то масса раствора составит 110 г. При описании растворов важной характеристикой является их концентрация, то есть сколько процентов в растворе занимает растворенное вещество. Если, например, масса раствора 110 г, а масса вещества 10 г, то, чтобы найти концентрацию раствора, надо 10 г разделить на 110 г и результат умножить на 100%: Концентрация растворов описывает массовую долю растворенного вещества (w) — отношение массы растворенного вещества к общей массе раствора. Именно отношение к массе раствора, а не массе растворителя. Массовую долю выражают как в долях (безразмерная единица) так и в процентах. Если масса раствора равна 200 г, а масса растворенного вещества в этом растворе равна 50 г, то массовая доля вещества 50/200 = 0,25 или 25%. Кроме того, можно найти массовую долю растворителя. Его масса равна 200 – 50 = 150 г, следовательно, 150/200 = 0,75 или 75%. Таким образом, массовая доля выражается формулой: w(вещества) = m(вещества) / m(раствора) Отсюда можно найти массу вещества, зная его массовую долю: m(вещества) = w(вещества) * m(раствора)  3. Допишите уравнения химических реакций, определите тип реакции, расставьте коэффициенты: MgCI2 + H2S04= MgSO4 + 2HCl Fe + 2HCI= FeCl2 + H2 3К20 + 2H3P04= 2K3PO4 + 3H2O
Билет-10 Физические свойства и применение водорода. Получение водорода. Положение в ПСХЭ
Самый распространённый элемент во вселенной – 92% от числа всех атомов Водород Н2 – это бесцветный газ, без запаха и вкуса, устойчив к нагреванию до 2000 °С. Практически не растворяется в воде. Получение: Генри Кавендиш впервые получил водород взаимодействием разбавленных серной и соляной кислот с металлами цинком, железом и оловом: Zn + H2SO4(разб.) = ZnSO4 + H2↑, Zn + 2HCl(разб.) = ZnCl2 + H2↑ В лаборатории для получения водорода используют взаимодействие разбавленных кислот (серной, соляной) с цинком (уравнение реакции см. выше), алюминия с растворами щелочей: 2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑ или реакции натрия и гидрида кальция с водой: 2Na + 2H2O = 2NaOH + H2↑ Получение и классификация оксидов. Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2. Называются они просто - "оксид + название элемента"(см. ниже).Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента. Классификация оксидов.
Основным оксидам соответствуют основания, кислотным-кислоты. К основным относятся оксиды металлов. К кислотным относят оксиды неметаллов. Получение оксидов.
3. Допишите уравнения химических реакций, определите тип реакции, расставьте коэффициенты: Fe + H2S04= FeSO4 + H2 Са + 2Н20= Ca(OH)2 + H2 2Na + 2НСl= 2NaCl + H2
Билет-11 |
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 267. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||