
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ГЕКСАЦИАНОФЕРРАТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ.ОПРЕДЕЛЕНИЕ МАССЫ ЦИНКА В РАСТВОРЕ
ЦЕЛЬ РАБОТЫ: уметь определять массу цинка в растворе его солей методом гексацианоферратометрического титрования.
ЦЕЛЕВЫЕ ЗАДАЧИ: 1. Приготовление раствора K4[Fe(CN)6] » 0,05 моль/л путем разбавления более концентрированного раствора. 2. Стандартизация раствора калия гексацианоферрата(II) по калия перманганату. 3. Определение массы цинка в растворе.
СТУДЕНТ ДОЛЖЕН ЗНАТЬ: 1. Сущность осадительного титрования. Требования к реакциям. Индикаторы. 2. Сущность и условия гексацианоферратометрического титрования. 3. Методику стандартизации раствора KMnO4 по Na2C2O4. 4. Методику определения массы цинка в растворах его солей. СТУДЕНТ ДОЛЖЕН УМЕТЬ: 1. Составлять уравнения реакций, используемых при гексацианоферратометрическом титровании. 2. Выполнять расчет массы определяемого вещества в растворе по результатам титрования.
КОНТРОЛЬНЫЕ ВОПРОСЫ: 1. Требования к реакциям, используемым в методе осаждения. 2. Ошибки в гексацианоферратометрическом титровании. «Ложная точка» конца титрования и фиксирование точки эквивалентности. 3. Приготовление и стандартизация раствора калия перманганата по натрия оксалату. 4. Условия протекания реакции между калия перманганатом и натрия оксалатом. 5. Определение ионов цинка в растворе осаждением калия гексацианоферратом(II).
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ: Реактивы: 1. Раствор K4[Fe(CN)6] с концентрацией C (K4[Fe(CN)6]) » 0,5 моль/л; 2. Стандартизованный раствор калия перманганата: С (1/5КМnО4) » 0,05 моль/л; 3. Раствор серной кислоты (1:4); 4. Раствор K3[(Fe(CN)6] (1%-ный); 5. Раствор дифениламина в концентрированной серной кислоте (1%-ный);  6. Водный раствор метилового фиолетового (0,1%-ный).
1. Приготовление 25 мл раствора калия гексацианоферрата(II) с концентрацией Раствор калия гексацианоферрата(II) готовят в склянке из темного стекла вместимостью 50 мл путем разбавления раствора с концентрацией
Стандартизация приготовленного раствора калия гексанианоферрата(II) Сущность методики Стандартизацию выполняют путем титрования раствора K4[Fe(CN)6] стандартизованным раствором КМnО4 в присутствии индикатора метилового фиолетового. Конец титрования фиксируют по изменению окраски индикатора. 5[Fe(CN)6]4– + МnО4–+ 8Н+ = 5[Fe(CN)6]3– + Мn2+ + 4Н2О Методика В колбу для титрования отбирают мерной пипеткой 2 мл приготовленного раствора калия гексацианоферрата(II), добавляют цилиндром 1 мл раствора H2SO4 (1:4), 1 каплю метилового фиолетового и титруют раствором калия перманганата из бюретки до перехода окраски раствора от зеленой к красно-коричневой. По результатам титрования рассчитывают точную концентрацию калия гексацианоферрата(II).
Определение массы цинка в растворе его соли Сущность методики Титрование соли цинка калия гексацианоферратом(II) основано на реакции осаждения: 3Zn2+ + 2K+ + 2[Fe(CN)6]4– ⇆ K2Zn3 [Fe(CN)6]2 (тв) Определение конечной точки титрования проводят с помощью окислительно-восстановительного индикатора дифениламина. Перед началом титрования в колбу добавляют 1 каплю калия гексацианоферрата(III), при этом индикатор существует в окрашенной форме. В конечной точке происходит увеличение концентрации калия гексацианоферрата(II), приводящее к уменьшению редокс-потенциала системы При прямом титровании цинка калия гексацианоферратом(II) может наблюдаться «ложная конечная точка» вследствие преждевременного обесцвечивания раствора. Появление «ложной точки» объясняется адсорбцией ионов цинка на поверхности осадка до наступления конечной точки титрования. После прохождения изоэлектрической точки осадок коагулирует, при этом освобождаются ионы цинка, которые реагируют с ионами калия гексацианоферрата(II), временно оказывающимися в избытке. Поэтому титровать необходимо медленно, при тщательном перемешивании содержимого колбы. Методика Полученную контрольную задачу в мерной колбе вместимостью 25 мл доводят водой до метки и тщательно перемешивают. В колбу для титрования мерной пипеткой отбирают 2 мл анализируемого раствора соли цинка, добавляют цилиндром 2 мл раствора H2SO4, одну каплю дифениламина и одну каплю раствора K3[Fe(CN)6]. Раствор при этом окрашивается в фиолетовый цвет. Медленно, при энергичном перемешивании титруют раствором калия гексацианоферрата(II) до появления салатовой окраски системы. Вблизи точки эквивалентности титрование замедляют, после прибавления очередной капли титранта содержимое колбы тщательно перемешивают в течение 10 с. Рассчитывают массу цинка в растворе по формуле:
где Статистическую обработку результатов определения массы цинка проводят в соответствии с рекомендациями [2], кн. 2, с. 7-25.
КОНТРОЛЬНЫЕ ВОПРОСЫ: 1. Каким образом проводится стандартизация раствора титранта? 2. Почему вблизи точки эквивалентности титруют медленно, при тщательном перемешивании? 3. Для чего добавляют перед титрованием раствор K3[Fe(CN)6]? 4. В какой цвет переходит индикатор в процессе титрования?
Тема занятия: КОМПЛЕКСОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ ЦЕЛЬ ИЗУЧЕНИЯ ТЕМЫ:на основе знания теоретических основ равновесий в растворах комплексных соединений, сущности метода комплексонометрии и навыков работы по титриметрическим методам анализа уметь выполнять комплексонометрическое титрование и обосновывать условия его проведения; уметь проводить расчеты по результатам титрования. Знание теории и практики метода комплексонометрического титрования необходимо для последующего изучения инструментальных методов анализа, изучения физической и коллоидной химии, фармацевтической, токсикологической химии, заводской и аптечной технологии лекарств. Комплексонометрическое титрование широко используется в практической деятельности провизора. ГФ XI рекомендует определять с помощью рассматриваемого метода соли кальция, магния, цинка, ртути, свинца в лекарственных препаратах. План занятия: 1. Модульная контрольная работа №5. 2. Объяснение преподавателем темы занятия, техники выполнения лабораторной работы, экспериментальной контрольной задачи и оформления лабораторного журнала. 3. Выполнение эксперимента – лабораторной работы № «Определение массы цинка и свинца в растворе» и контрольной задачи №2: «Определение массы железа (III) и кальция в растворе». 4. Уборка рабочих мест и сдача дежурными лаборатории лаборантам. 5. Проверка результатов, составление и защита отчетов. 6. Объяснение преподавателем новой темы и выполнения домашнего задания. Количество часов: 5 ч. Лабораторная работа №16 |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 1577. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
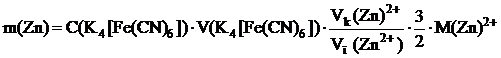
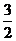 – стехиометрический коэффициент перехода от числа молей титранта к числу молей цинка.
– стехиометрический коэффициент перехода от числа молей титранта к числу молей цинка.