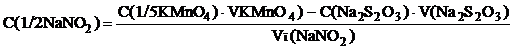Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Замещение избыточного брома йодом и титрование последнего натрия тиосульфатомВ раствор добавляют 0,2 г сухого калия иодида, содержимое колбы тщательно перемешивают, закрывают колбу часовым стеклом и оставляют в темном месте. Через 10 мин добавляют мерным цилиндром 1 мл хлороформа и медленно титруют при энергичном перемешивании выделившийся йод стандартным раствором натрия тиосульфата до обесцвечивания шариков хлороформа на дне колбы. Расчет массовой доли натрия салицилата в препарате Массовую долю натрия салицилата в препарате рассчитывают по формуле:
где М(1/6NаООСС6Н4ОН) = 26,69 г/моль
КОНТРОЛЬНЫЕ ВОПРОСЫ: 1. Напишите уравнения реакций, лежащих в основе бромометрического определения натрия салицилата. 2. Напишите формулу, по которой рассчитывают массовую долю натрия салицилата в препарате, и объясните ее. 3. Чему равна молярная масса эквивалента натрия салицилата при бромометрическом титровании? 4. Какой индикатор используют при бромометрическом определении натрия салицилата? 5. Перечислите основные этапы методики определения натрия салицилата бромометрическим методом. 6. Какие стандартные растворы используют при выполнении этого определения? 7. Почему подкисленный раствор натрия салицилата после добавления бромид-броматной смеси закрывают часовым стеклом и выдерживают 10 мин? Напишите соответствующие уравнения реакций. 8. Объясните, почему при бромометрическом определении натрия салицилата с иодиметрическим окончанием необходимо медленно добавлять натрия тиосульфат и энергично перемешивать титруемый раствор? 9. Можно ли при этом титровании в качестве индикатора использовать раствор крахмала? 10.Как проверить отсутствие примесей калия иодата и калия бромата соответственно в растворе калия иодида и бромида?  Лабораторная работа № 13 НИТРИТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ. ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ НОВОКАИНА В ПРЕПАРАТЕ
ЦЕЛЬ РАБОТЫ: уметь определять методом нитритометрического титрования вещества, содержащие первичную ароматическую аминогруппу.
ЦЕЛЕВЫЕ ЗАДАЧИ: 1. Приготовление титранта – раствора натрия нитрита. 2. Стандартизация раствора натрия нитрита по стандартизованному раствору калия перманганата. 3. Определение массовой доли новокаина в препарате. 4. Статистическая обработка полученных результатов.
СТУДЕНТ ДОЛЖЕН ЗНАТЬ: 1. Возможности метода нитритометрического титрования. 2. Сущность нитритометрического определения веществ, содержащих первичную ароматическую аминогруппу. 3. Сущность методики стандартизации титранта – раствора натрия нитрита СТУДЕНТ ДОЛЖЕН УМЕТЬ: 1. Составлять уравнения реакций и рассчитывать молярную концентрацию раствора натрия нитрита при стандартизации его по стандартизованному раствору калия перманганата. 2. Составлять в общем виде уравнение реакции, лежащей в основе нитритометрического титрования веществ, содержащих первичную ароматическую аминогруппу, и рассчитывать массовую долю определяемого вещества в препарате.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ: 1. Какие свойства может проявлять нитрит-ион в зависимости от природы реагирующего с ним вещества? 2. Какая реакция лежит в основе нитритометрического титрования веществ, содержащих первичную ароматическую аминогруппу? Напишите уравнение реакции в общем виде. Каковы оптимальные условия ее протекания? 3. Какие индикаторы применяют для установления точки эквивалентности в нитритометрическом титровании? 4. Напишите и объясните формулу, по которой рассчитывают массовую долю определяемого вещества в препарате по результатам нитритометрического титрования. 5. Как приготовить 0,1 моль/л раствор натрия нитрита при наличии сухой соли? 6. Какие вещества можно использовать в качестве первичных или вторичных стандартов для стандартизации раствора натрия нитрита? 7. Напишите уравнения реакций, лежащих в основе стандартизации раствора натрия нитрита с помощью вторичного стандарта обратным перманганатометрическим титрованием с иодиметрическим окончанием. Чему равны факторы эквивалентности натрия нитрита, калия перманганата и натрия тиосульфата в соответствующих реакциях?
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ: Реактивы: 1. Натрия нитрит; 2. Калия бромид; 3. Стандартизованный раствор калия перманганата С (1/5КМnO4) = 0,05 моль/л; 4. Стандартизованный раствор натрия тиосульфата C (Na2S2O3) = 0,05 моль/л; 5. Раствор серной кислоты 1 моль/л; 6. Хлороводородная кислота (ρ = 1,175 г/см3); 7. Хлороводородная кислота С (НСl) = 2 моль/л; 8. Раствор калия йодида (10%-ный); 9. Раствор крахмала (0,2%-ный); 10. Водный раствор тропеолина 00 (0,03%-ный); 11. Водный раствор метилового синего (0,02%-ный).
Приготовление 50 мл раствора натрия нитрита C (NaNO2) » 0,1 моль/л Рассчитанную навеску натрия нитрита берут на аптечных весах, помещают в склянку вместимостью 70-80 мл и растворяют в небольшом объеме воды, доводя затем конечный объем раствора водой до 50 мл при помощи мерного цилиндра (раствор А).
Стандартизация раствора натрия нитрита по стандартизованному раствору калия перманганата Сущность методики Стандартизацию проводят обратным перманганатометрическим титрованием с иодиметрическим окончанием. К точно известному количеству вещества эквивалента калия перманганата, взятому в избытке по отношению к натрия нитриту, прибавляют раствор серной кислоты, а затем известный объем раствора натрия нитрита. Не следует прибавлять реагенты в обратном порядке, так как нитрит-ион в отсутствии перманганата легко разлагается кислотами с выделением оксидов азота. После завершения реакции: 5NO2–+ 2MnO4–+ 6Н+ = 5NO3–+ 2Мn2+ + 3Н2О к раствору с непрореагировавшим перманганат-ионом добавляют избыток калия иодида (стадия замещения): 2MnO4–+ 10I– + 16H+ = 2Mn2+ + 5I2 + 8Н2О Выделившийся йод оттитровывают стандартизованным раствором натрия тиосульфата в присутствии крахмала. По закону эквивалентов при стандартизации раствора натрия нитрита реагирующие вещества связаны между собой соотношением: n (1/5КМnО4) = n (1/2NaNO2) + n (Na2S2O3) Методика Раствор натрия нитрита (раствор А) предварительно разбавляют в 5 раз: в мерную колбу вместимость 25 мл отбирают пипеткой 5 мл раствора А и доводят объем раствора водой до метки (раствор Б). Стандартизуют раствор Б. Для этого в колбу для титрования вместимостью 50 мл отбирают пипеткой 2 мл стандартизованного раствора калия перманганата С (1/5KMnO4) » 0,05 моль/л, добавляют 1 мл 1 моль/л раствора серной кислоты, раствор нагревают на водяной бане до 40°С и медленно прибавляют к нему из пипетки при непрерывном перемешивании 1 мл раствора Б. Через 15-20 мин приливают 1 мл 10%-ного раствора калия йодида, накрывают колбу часовым стеклом и выдерживают в темном месте в течение 5 мин. Далее к раствору прибавляют 10 мл воды и титруют стандартизованным раствором натрия тиосульфата C (Na2S2O3) » 0,05 моль/л до слабожелтой окраски, прибавляют 1 мл 0,2%-ного раствора крахмала и продолжают титровать до резкого перехода окраски раствора из синей в бесцветную. Рассчитывают молярную концентрацию эквивалента NaNO2.
и молярную концентрацию натрия нитрита в растворе Б. Молярную концентрацию натрия нитрита в растворе А рассчитывают с учетом его разбавления.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 680. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
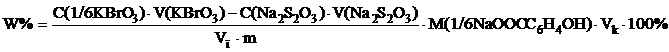 ,
,