
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Определение массы железа(II) в растворе солиВ основе определения лежит реакция: 5Fe2+ + MnO–4 + 8Н+ ⇆ 5Fe3+ + Мn2+ + 4Н2О Методика В полученную в мерной колбе вместимостью 25 мл контрольную задачу добавляют мерным цилиндром 10 мл раствора серной кислоты с концентрацией 1 моль/л, доводят раствор до метки и перемешивают. В колбу для титрования отбирают пипеткой 2 мл приготовленного раствора соли железа(II) и титруют раствором калия перманганата. Рассчитывают массу железа(II) в растворе. Полученные результата обрабатывают методом математической статистики. Определение массы железа(II) в сухом образце соли железа(II) Методика Готовят раствор анализируемой соли железа с примерной молярной концентрацией C(Fe2+) = 0,05 моль/л. Необходимую массу навески рассчитывают по формуле:
Массовая доля железа W% (Fe2+) в контрольных образцах солей железа колеблется в пределах 10–13%. Навеску образца соли железа(II) взвешивают в бюксе на аналитических весах и переносят при помощи воронки в мерную колбу вместимостью 25 мл. Для предотвращения гидролиза соли добавляют мерным цилиндром 10 мл раствора серной кислоты с молярной концентрацией 1 моль/л. После растворения соли объем раствора доводят водой до метки и перемешивают. Далее поступают, как описано выше при определении железа(II) в растворе соли. Расчет массовой доли железа в анализируемом образце проводят по формуле:
где m — масса навески анализируемого образца соли, г.
Внимание! После окончания работы неиспользованный раствор перманганата сдать лаборанту. Бюретку промыть и залить водой. КОНТРОЛЬНЫЕ ВОПРОСЫ: 1. Как рассчитывают массу навески натрия оксалата, необходимую для приготовления стандартного раствора?  2. Как рассчитывают молярную концентрацию эквивалента и титр стандартного раствора натрия оксалата, приготовленного по точной навеске? 3. Как отсчитывают уровень раствора калия перманганата в бюретке в процессе титрования? 4. Почему при титровании горячего раствора натрия оксалата калия перманганатом первые капли титранта обесцвечиваются медленно? 5. Какую кислоту используют для подкисления при этом титровании? 6. По каким формулам рассчитывают молярную концентрацию и титр калия перманганата по результатам титрования? 7. По какой формуле рассчитывают массу водорода пероксида в растворе по результатам прямого перманганатометрического титрования? 8. Как рассчитать необходимую для анализа перманганатометрическим методом массу навески соли железа(II)? 9. Почему при растворении навески соли железа(II) в воде раствор подкисляют серной кислотой? 10. Можно ли определять методом перманганатометрического титрования окислители?
Лабораторная работа № 10 |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 593. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
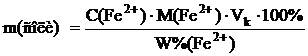
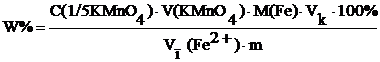 ,
,