
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
КОНТРОЛЬНАЯ ЛАБОРАТОРНАЯ ЗАДАЧА №1.ОПРЕДЕЛЕНИЕ МАССЫ АММИАКА В РАСТВОРАХ АММОНИЕВЫХ СОЛЕЙ ЦЕЛЬ РАБОТЫ: уметь практически определять массу аммиака в растворах, аммониевых солей методом кислотно-основного титрования. План занятия: 1. Модульная контрольная №4. 2. Объяснение преподавателем темы занятия, техники выполнения экспериментальной контрольной задачи и оформления лабораторного журнала. 3. Выполнение эксперимента – контрольной задачи №1: «определение массы аммиака в растворах аммониевых солей». 4. Уборка рабочих мест и сдача дежурными лаборатории лаборантам. 5. Проверка результатов, составление и защита отчетов. 6. Объяснение преподавателем новой темы и выполнения домашнего задания. Количество часов: 5ч.
ЦЕЛЕВЫЕ ЗАДАЧИ: 1. Определение аммиака в растворе аммониевой соли обратным и косвенным титрованием. 2. Письменная контрольная работа по теме «Метод кислотно-основного титрования». СТУДЕНТ ДОЛЖЕН ЗНАТЬ: 1. Сущность метода косвенного и обратного титрования. 2. Сущность методики определения аммиака в растворах аммониевых солей.
СТУДЕНТ ДОЛЖЕН УМЕТЬ: 1. Выполнять все виды расчетов, применяемых в титриметрическом анализе при проведении кислотно-основного титрования. 2. Решать типовые расчетные задачи по теме "Кислотно-основное титрование".
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ: Реактивы: 1. Хлороводородная кислота С (НСl) = 0,1 моль/л, стандартизированная на предыдущем занятии. 2. Стандартный раствор гидроксида натрия С (NaOH) = 0,1 моль/л. 3. Водный раствор формальдегида (40%-ный), не содержащий примеси органических кислот. 4. Красная лакмусовая бумага.
КОНТРОЛЬНЫЕ ВОПРОСЫ:  1. Как проводят стандартизацию раствора гидроксида натрия? 2. В чем состоит сущность метода обратного титрования? Разберите на примере определения аммиака в солях аммония. 3. В чем состоит сущность метода косвенного титрования? Разберите на примере формальдегидного метода определения аммиака в солях аммония. 4. Напишите реакцию разложения иона аммония под воздействием щелочи. 5. Как рассчитать водородную и гидроксидную ошибки титрования?
Прямые методы определения аммиака в водных растворах солей аммония отсутствуют. Существует несколько косвенных способов определения аммиака в аммониевых солях. Для анализа чистых солей, не содержащих примесей кислот и мешающих солей, наиболее пригодными являются метод обратного титрования и формальдегидный метод. Определение массы аммиака в солях аммония обратным титрованием Сущность методики К анализируемому раствору соли аммония, например, NH4Cl добавляют в избытке точно известное количество стандартного раствора гидроксида натрия. После удаления аммиака кипячением раствора NH4+ +ОН– ® NH3(r) + H2O избыток щелочи оттитровывают стандартным раствором хлороводородной кислоты в присутствии индикатора метилового оранжевого. Молярную концентрацию соли аммония рассчитывают из соотношения, связывающего количества реагирующих веществ: n (NaOH) = n (NH4Cl) + n (HCl), C (NaOH) • V (NaOH) = C (NH4Cl) • V (NH4Cl) + C (HCl) • V (HCl),
где Vп (NH4Cl) – объем раствора соли аммония для титрования; C (NaOH) и V (NaOH) – концентрация и объем раствора щелочи, взятой в избытке; С (НСl) и V (HCl) – концентрация и объем хлороводородной кислоты, затраченной на титрование; C (NH4Cl) – концентрация соли, моль/л. Массу аммиака в анализируемом растворе рассчитывают по формуле; m (NH3) = C (NH4Cl) • M (NH3) • Vk (NH4Cl) Понятно, что указанное соотношение справедливо только для солей одноосновных кислот. Методика Разложение соли аммония и удаление аммиака с последующим титрованием избытка гидроксида натрия раствором хлороводородной кислоты Полученную от преподавателя контрольную задачу в мерной колбе вместимостью 25 мл разбавляют дистиллированной водой до метки и тщательно перемешивают. В колбу для титрования отбирают мерной пипеткой 1 мл приготовленного раствора, добавляют из бюретки 2 мл стандартного раствора гидроксида натрия, предварительно стандартизированного по хлороводородной кислоте. Колбу нагревают на асбестовой сетке пламенем газовой горелки до кипения, после чего кипятят еще 5-10 минут, не допуская разбрызгивания, до получения отрицательной реакции на аммиак. Полноту удаления аммиака проверяют, держа над паром влажную розовую лакмусовую бумажку, которая не должна синеть. Содержимое колбы охлаждают, обмывая стенки колбы водой до восстановления первоначального объема раствора и титруют стандартным раствором хлороводородной кислоты с одной каплей индикатора метилового оранжевого до золотисто-оранжевой окраски раствора. Титрование проводят не менее пяти раз.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 719. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
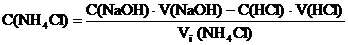 .
.