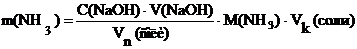Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Расчет массы аммиака в растворе соли аммонияМассу аммиака рассчитывают по формуле:
По результатам титрования можно вычислить гидроксидную ошибку титрования сильной кислоты раствором щелочи в присутствии фенолфталеина:
Молярная концентрация ионов водорода в титруемом растворе была равна:
Подставляя это выражение в формулу для расчета гидроксидной ошибки, получим:
КОНТРОЛЬНЫЕ ВОПРОСЫ 1. Можно ли использовать формальдегидный метод определения аммиака в растворе солей аммония, содержащем примесь кислот? Ответ мотивируйте. 2. Можно ли использовать обратное титрование для определения аммиака в растворе солей аммония, содержащих посторонние соли и кислоты? 3. Объясните, почему титрование раствора кислоты раствором щелочи 4. Почему раствор формальдегида нейтрализуют щелочью перед использованием в работе? 5. Как удаляют аммиак из раствора соли аммония? 6. Как определяют полноту удаления аммиака из раствора соли аммония? 7. По какой формуле подсчитывают массу аммиака в растворе при обратном титровании? 8. Почему при титровании хлороводородной кислоты щелочью в присутствии фенолфталеина через некоторое время после окончания титрования розовая окраска раствора исчезает? 9. По какой формуле рассчитывают массу аммиака в соли аммония при косвенном титровании (формальдегидный метод)?
Тема занятия: МЕТОДЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО ТИТРОВАНИЯ ЦЕЛЬ ИЗУЧЕНИЯ ТЕМЫ: на основе знаний теории процессов окисления и восстановления и навыков работы по титриметрическим методам анализа уметь обоснованно выбирать и использовать метод окислительно-восстановительного титрования для определения окислителей и восстановителей.  Знание теории и практики методов окислительно-восстановительного титрования необходимо для последующего изучения инструментальных методов анализа, изучения физической и токсикологической химии, заводской и аптечной технологии лекарств, практической деятельности провизора. Изучаемые методы окислительно-восстановительного титрования являются фармакопейными. С использованием этих методов согласно ГФ XI издания определяют многие лекарственные вещества: калия перманганат, йод, перекись водорода, мышьяк(III), новокаин, стрептоцид и т.п. При судебно-химических исследованиях в биологических объектах определяют сурьму(III), мышьяк(III), фенолы, крезолы и т.д. Лабораторная работа № 9 ПЕРМАНГАНАТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ. ОПРЕДЕЛЕНИЕ МАССЫ ПЕРОКСИДА ВОДОРОДА В РАСТВОРЕ. ОПРЕДЕЛЕНИЕ МАССОВОЙ ДОЛИ ЖЕЛЕЗА(II) В РАСТВОРЕ И В СУХОМ ОБРАЗЦЕ
ЦЕЛЬ РАБОТЫ:уметь выполнять определение восстановителей в растворе методом прямого перманганатометрического титрования. План занятия: 1. Проверка домашнего задания и опрос студентов по материалу текущей лекции. 2. Контрольный тест №5. 3. Объяснение преподавателем темы занятия, техники проведения эксперимента и оформления лабораторного журнала. Выполнение эксперимента – лабораторной работы №9: «Определение массы пероксида водорода в растворе» и «Определение массовой доли железа (II) в растворе и сухом образце» и лабораторной работы №10: «Определение содержания нитрит-ионов». 5. Уборка рабочих мест и сдача дежурными лаборатории лаборантам. 6. Объяснение преподавателем новой темы и выполнения домашнего задания. Количество часов: 6 ч.
ЦЕЛЕВЫЕ ЗАДАЧИ: 1. Приготовление раствора перманганата калия с заданной концентрацией путем разбавления более концентрированного раствора. 2. Приготовление стандартного раствора натрия оксалата по навеске с точно известной массой; расчет молярной концентрации эквивалента и титра приготовленного раствора. 3. Стандартизация раствора перманганата калия по раствору натрия оксалата. 4. Определение массы водорода пероксида в растворе. 5. Определение массовой доли железа(II) в растворе и в сухом образце. 6. Статистическая обработка результатов анализа. СТУДЕНТ ДОЛЖЕН ЗНАТЬ: 1. Основные понятия окислительно-восстановительных процессов, окислительно-восстановительные потенциалы редокс-систем, уравнение Нернста. 2. Методика построения кривых окислительно-восстановительного титрования. 3. Сущность и условия перманганатометрического титрования. 4. Примеры перманганатометрического определения восстановителей. СТУДЕНТ ДОЛЖЕН УМЕТЬ: 1. Составлять уравнения окислительно-восстановительных реакций. 2. Рассчитывать молярные массы эквивалента калия перманганата, водорода пероксида, солей железа(II) в реакциях окисления-восстановления. КОНТРОЛЬНЫЕ ВОПРОСЫ: 1. Какие реакции называют окислительно-восстановительными? 2. Дайте определение понятиям: окисление, восстановление, окислитель, восстановитель. 3. Какие из приведенных ниже уравнений реакций являются окислительно-восстановительными? 2KMnO4 + 16HCl ® 2KCl + 2MnCl2 + 5Cl2 + 8H2O Mn (OH)2 + 2HCl ® MnCl2 + 2H2O 6KI + K2Cr2O7 +7H2SO4 ® 5I2 + 4K2SO4 + Cr2 (SO4)3 + 7H2O 2NaHCO3 ® Na2CO3 + CO2 + H2O Укажите в них окислитель и восстановитель. 4. Допишите следующие реакции, расставьте в них коэффициенты, используя метод электронно-ионного баланса: КМnО4 + Н2О2 + H2SO4 ® KMnO4 + KNO2 + H2SO4 ® K2Cr2O7 + KNO2 + H2SO4 ® KMnO4 + FeSO4 + H2SO4 ® KMnO4 + H2C2O4 + H2SO4 ® 5. Чему равна молярная масса эквивалента калия перманганата, калия дихромата, железа(II) сульфата, водорода пероксида, натрия нитрита, щавелевой кислоты в вышеперечисленных реакциях? 6. Почему стандартный раствор калия перманганата не может быть приготовлен по навеске с точно известной массой? 7. Какие процессы протекают в свежеприготовленном растворе калия перманганата? 8. Почему растворы калия перманганата хранят в темных склянках? 9. Какие вещества можно определять прямым перманганатометрическим титрованием? 10. От каких факторов зависит реальный потенциал окислительно-восстановительной пары? Напишите уравнения Нернста. 11. Какие величины используют для оценки точности результатов анализа? Как вычисляют эти величины?
МАТЕРИАЛЬНОЕ ОБЕСПЕЧЕНИЕ: Реактивы: 1. Натрия оксалат Na2C2O4. 2. Раствор калия перманганата С (1/5 КМnО4) = 0,5 моль/л. 3. Раствор серной кислоты С (H2SO4) = 1 моль/л. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 839. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |