
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Результаты титрования раствора гидроксида натрия
Расчет массы щелочи Массу щелочи в анализируемом растворе рассчитывают двумя способами:
С использованием титриметрического фактора пересчета титранта — рассчитывают теоретический титр раствора соляной кислоты по щелочи:
где С (НСl) теор = 0,1000 моль/л.
— рассчитывают поправочный коэффициент титранта:
где С (НСl) – практическая молярная концентрация кислоты, используемой в анализе.
— рассчитывают массу щелочи в анализируемом растворе:
С использованием молярной концентрации титранта - рассчитывают молярную концентрацию щелочи в анализируемом растворе:
- рассчитывают массу щелочи в анализируемом растворе:
Молярную массу M (NaOH) находят по табл. 4 справочника Лурье.
Статистическая обработка результатов анализа Руководствуясь материалами [2], кн. 2, с.7-25, рассчитывают значения массы щелочи в колбе, соответствующие результатам пяти титрований, среднее значение массы щелочи в колбе (m$), отклонение di и квадраты отклонений. Результаты заносят в таблицу отклонений (табл. 3). Таблица 3 Таблица отклонений
Затем рассчитывают сумму квадратов отклонений  Таблица 4 Итоговая таблица
Определение массы щелочи и карбонатов при совместном присутствии» Сущность методики Щелочи NaOH и КОН и их растворы обычно содержат примеси соответствующих карбонатов. Эти вещества могут быть раздельно определены титрованием раствора стандартным раствором хлороводородной кислоты с двумя индикаторами. Сначала оттитровывают щелочь и половину карбоната (до гидрокарбоната): OH– + H3O+ ⇆ 2H2O CO32– + H3O+ ⇆ H2O + HCO3– Величина рН полученного раствора определяется при этом присутствием НСО3–ионов и равна: рН = 1/2 (p Поэтому первое титрование ведут с фенолфталеином (рТ = 9). Объем титранта при этом титровании V1 (HCl) эквивалентен всей щелочи и половине карбоната, присутствующих в растворе. При дальнейшем добавлении кислоты происходит превращение гидрокарбонат-иона в угольную кислоту. Затраченный при этом объем титранта эквивалентен второй половине карбонатов, присутствующих в растворе: НСО3– + Н3О+ = 2Н2О + СО2 Величина рН полученного раствора определяется присутствием угольной кислоты и равна: рН = 1/2 (р Молярная концентрация угольной кислоты зависит от количества карбоната и может немного отличаться от 10–2 моль/л, однако это не вносит большой ошибки в расчет величины рН. В соответствии с полученным значением рН второе титрование ведут с метиловым оранжевым (рТ = 4). Объем титранта, израсходованный при титровании с двумя индикаторами, V2 (HCl) эквивалентен щелочи и всему карбонату, присутствующим в растворе. Поэтому объем V2 (HCl) – V1 (HCl) равен объему титранта, эквивалентному половине карбоната, а объем 2[V2 (HCl) – V1 (HCl)] – объему титранта, эквивалентному всему карбонату, присутствующему в растворе. Отсюда объем титранта, эквивалентный щелочи, равен: V2 (HCl) – 2[V2 (HCl) – V1 (HCl)] = 2V1 (HCl) – V2 (HCl) Методика |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 949. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 (HCl)
(HCl)


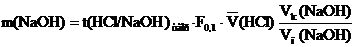


 , определяют стандартные отклонения (S), полуширину доверительного интервала среднего Δ
, определяют стандартные отклонения (S), полуширину доверительного интервала среднего Δ  (при n=5 и p=0,95), рассчитывают относительную ошибку среднего
(при n=5 и p=0,95), рассчитывают относительную ошибку среднего  . Полученные результаты представляют в виде итоговой таблицы.
. Полученные результаты представляют в виде итоговой таблицы.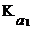 + р
+ р 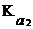 ) = 1/2 (6,35 + 10,32) = 8,34
) = 1/2 (6,35 + 10,32) = 8,34