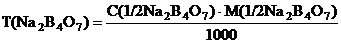Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Приготовление 50 мл стандартного раствора натрия тетраборатаC(1/2 Na2B4O7) = 0,1 моль/л Раствор натрия тетрабората готовят по навеске с точно известной массой кристаллического натрия тетрабората Na2B4O7 • 10 Н2О. Необходимую массу рассчитывают по формуле: m (Na2B4O7 • 10Н2О) = C (1/2Na2B4O7) • M (1/2Na2B4O7 • 10Н2О) • Vk (Na2B4O7), где С (1/2Na2В4О7) – молярная концентрация эквивалента натрия тетрабората, моль/л;
M (1/2Na2B4O7 • 10Н2О) – молярная масса эквивалента натрия тетрабората, г/моль, находят на основании уравнения реакции: В4О72– + 5Н2О + 2Н+ D 4Н3ВО3 Vk (Na2B4O7) – объем приготавливаемого раствора натрия тетрабората, л. Навеску с рассчитанной массой вначале взвешивают на аптечных весах, переносят в стеклянный бюкс, бюкс с навеской взвешивают на аналитических весах. Записывают результат взвешивания m1. Содержимое бюкса через сухую воронку осторожно переносят в мерную колбу вместимостью 50 мл. Бюкс с остатками соли вновь взвешивают на аналитических весах m2. Точную массу навески соли, взятую для приготовления раствора, определяют по разности масс бюкса до и после его опорожнения m1 – m2. Воронку обмывают струей горячей воды из промывалки, после чего заполняют колбу водой до половины объемы. Содержимое колбы перемешивают вращательным движением до полного растворения буры, охлаждают до комнатной температуры и доливают водой до метки, (последние капли добавляют с помощью пипетки). Колбу закрывают пробкой и тщательно перемешивают раствор, переворачивая ее вверх дном 25 — 30 раз. Концентрацию приготовленного раствора вычисляют по формулам:
или На этикетке колбы обозначают содержимое, фамилию студента, номер группы.
Стандартизация раствора хлороводородной кислоты по тетраборату натрия  Сущность методики Стандартизацию проводят путем титрования стандартного раствора натрия тетрабората раствором хлороводородной кислоты. Приготовленный раствор натрия тетрабората имеет щелочную реакцию вследствие гидролиза В4О72– + 7Н2О D 2ОН– + 4Н3ВО3 При титровании этого раствора соляной кислотой происходит связывание ионов ОН– в молекулы воды. Суммарное уравнение имеет следующий вид: В4О72– + 5Н2О + 2Н+ D 4Н3ВО3 или Na2B4O7 + 5Н2О + 2HCI D 2NaCl + 4Н3ВО3 В т.э. в растворе находятся натрия хлорид и слабая борная кислота. Хлорид натрия не подвергается гидролизу, поэтому pH в т.э. определяет процесс ионизации борной кислоты. Из суммарного уравнения реакции следует, что на 1 моль натрия тетрабората образуется 4 моль борной кислоты. Поэтому молярная концентрация борной кислоты в т.э. с учетом разбавления раствора в 2 раза равна: С (Н3ВО3) = 0,05 • 4/2 = 0,1 моль/л. Следовательно, pH раствора в т.э. равен: pH = 1/2 (pКа + рСа) = 1/2 (9,15 + 1,00) = 5,07 Из этого следует, что титрование необходимо проводить с кислотно-основными индикаторами, имеющими показатель титрования рТ, близкий к 5, т.е. с метиловым красным (рТ = 5), метиловым оранжевым (рТ = 4) или со смешанным индикатором (рТ = 4,1). Методика Титрование стандартного раствора натрия тетрабората |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 1010. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |