Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
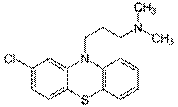
Производные фенотиазина (аминазин, дипразин, левомепромазин, тиоридазин). Токсикологическое значение, изолирование, анализ.Изолирование:Метод Стаса-Отто, модифицированный Соломатиным. Извлекатель – этанол, подкисленный щавелевой кислотой. Вытяжку упаривают. Очистка от белков – 96% этанолом,от липофильных в-в – экстракцией эфиром. Фильтруют. Упаривают. Растворяют в воде, + щавелев. к-ту до рН 2-3, + эфир. Далее + NaOH до рН 13, экстрагируют эфиром. Реэкстрагируют H2SO4. t – для удаления эфира. Аминазин (Хлорпромазин)
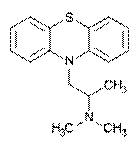
Качественные реакции: 1. С реактивом Марки (H2SO4 конц. с формалином): хлороформ. вытяжка из щелоч. среды выпаривают + реактив - бледно-пурпурное окрашивание. 2.С конц. HNO 3 - фиолетовое, переходящее в пурпурное и в красное окрашивание. 3.С 2% раствором FeCl3 - малиновое окрашивание. 4.Реакция Витали-Морена: р-р исслед. в-ва t, к сухому остатку + HNO3, t – желтый остаток + ацетон (с одной стороны) и 10% р-р NaOH в этаноле - пурпурное с фиолетовым оттенком окрашивание. 5. С реактивом Манделина (ванадат аммония и H2SO4 конц.) - темно-пурпурное, быстро исчезающее окрашивание. Дипразин (Пипольфен)
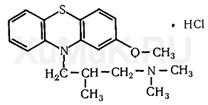
Качественные реакции: 1. С реактивом Марки; 2. С конц. HNO 3 - красно-желтое окрашивание; 3. С 2% раствором FeCl 3 - грязно-сиреневое окрашивание; 4. Реакция Витали-Морена; 5. С реактивом Манделина - темно-пурпурное окрашивание. Левомепромазин (Тизерцин)
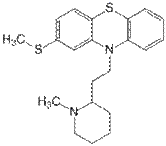
Качественные реакции: 1. С конц. H2SO4 - фиолетовое или розово-фиолетовое окрашивание; 2. С HClO 4 и NaNO 2 - фиолетовое окрашивание; 3. С H 2 PtCl 6 - ярко-зеленое окрашивание; 4. С 2% раствором FeCl 3 - розово-фиолетовое окрашивание; 5. С реактивом Марки - фиолетовое или розово-фиолетовое окрашивание; 6. Реакция Витали-Морена - красно-оранжевое. Тиоридазин (Сонапакс)
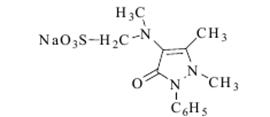
Качественные реакции: С конц. H2SO4 - голубое окрашивание; 2. С HClO4 и NaNO2 - зелено-голубое окрашивание; 3. С реактивом Марки - окрашивание цвета морской волны; 4. С H2PtCl6 бледно-сиреневое окрашивание; 5.С 2% раствором FeCl3 - голубовато-зеленое окрашивание; 6. Реакция Витали-Морена - пурпурное окрашивание;  Токсикологическое значение: психотропные средства, проявляют токсическое действие. Введение в дозах, превышающих терапевтические приводит к летальным исходам. Антипирин, аминофеназон, анальгин. Токсикологическое название, Изолирование и название.
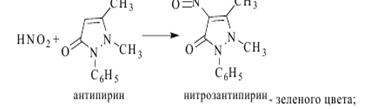
Реакции обнаружения: 1. Образование нитрозоантипирина.
2. Образование зокрасителя: к нитрозоантипирину прибавляем α-нафтиламин (фиолетовое окрашивание). 3. С FeCl3 (красное окрашивание). Колич. опред.: СФМ при λmax=230 нм в 0,1н растворе H2SO4 и ГЖХ. Аминофеназон
2. С р-ром HNO3: на предм. стекло иссл. Р-р, выпаривают+вода+1% р-р H2SO4 и неск капель NaNO2- фиолетовый исчезает 3. С р-ром AgNO3: иссл. Р-р+1% AgNO3 - фиолетовое окрашивание, может выпадать осадок черного цвета. Анальгин
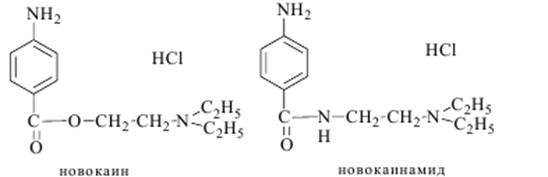
2. Реакция на натрий с цинк-уранилацетатом. 3. С KIO3 (малиновое окрашивание). 4. С реактивом Миллона [Hg(NO3)2+Hg2(NO3)2] (темно-синее окрашивание). Количественное определение: ВЭЖХ. 58. Производное парааминобензойной кислоты (новокаин, новокаинамид). Токсикологическое название, Изолирование и название.
Новокаинамид по химическому строению близок к новокаину, хотя по фармакологическим свойствам он применяется как антиаритмическое средство – способен понижать возбудимость и проводимость сердечной мышцы.Новокаин и новокаинамид растворяются в воде и этаноле, не растворяются в эфире и хлороформе. Обладают основными свойствами (рКвн+=9 для новокаина и 9,24 - для новокаинамида). Имеют характерные интенсивные полосы поглощения в УФ- спектрах, формы спектров изменяются в зависимости от рН. Изолирование из тканей трупов проводится подкисленной водой, экстракция – хлороформом из щелочных растворов. Анализ экстрактов проводится методом ТСХ-скрининга в общих и частных системах растворителей. Для качественного обнаружения применяют реакции осаждения (реактив Драгендорфа, раствор бромида золота), окрашивания (образование азокрасителя с бета-нафтолом, оранжево-желтое окрашивание по реакции Витали-Морена), также УФ- спектрофотометрию. Количественное определение: УФ- спектрофотометрия, фотометрия по реакции образования азокрасителя. Метаболизм. Новокаин быстро гидролизуется до пара-аминобензойной кислоты и диэтиламиноэтанола, только 2% этого препарата выделяется с мочой в неизмененном виде. Около 90% дозы новокаина выводится с мочой в виде ПАБК (в свободной форме и в виде коньюгатов). В свободном виде выводится и 30% диэтиламиноэтанола. Максимальная концентрация новокаинамида обнаруживается в плазме через 15 – 60 минут после орального введения. Основным метаболитом является фармакологически активный N-ацетилновокаинамид. Около 50% новокаинамида выводится с мочой в неизмененном виде, 2-10% метаболизирует до ПАБК. Обнаружены также N- деметилированные метаболиты. Период полувыведения новокаинамида – 3 – 5 часов.
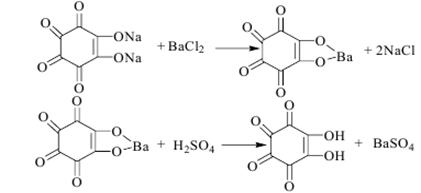
59.Минеральные кислоты (серная, хлороводорная, азотная). Токсикологическое название, Изолирование и название. Серная кислота Обнаружение сульфат-ионов еще не является доказательством отравления серной кислотой, т.к. сульфаты находятся в организме в естественных количествах. 1. Конц. серная кислота способна обугливать углеводы. 2. Сульфаты с р-ром BaCl2 дают белый осадок, однако это не указывает на присутствие свободной серной кислоты. 3. Перегонка свободной серной кислоты проводится в обычном перегонном аппарате. Ан. р-р помещают в колбу и прибавляют медные опилки, нагревают. В приемнике находится р-р йода в иодиде калия. Если р-р йода обесцвечивается, его добавляют до тех пор пока р-р йода перестанет обесцвечиваться. 2H2SO4 + Cu = CuSO4 + H2SO3 + H2O H2SO3⇔ H2O + SO2 ↑ SO2 + I2 + 2HOH = HI + H2SO4 Приемник отделяют, р-р подкисляют разведенной HCl и нагревают до удаления йода. Затем прибавляют: 1) BaCl2 (BaSO4↓,что указывает на наличие свободной H2SO4);2) ацетат свинца – выпадает белый осадок сульфата свинца;3) родизонат натрия с BaCl2 - красное окрашивание. При добавлении дистиллята, содержащего сульфат-ион, происходит обесцвечивание:
Азотная кислота. Качественное определение: 1. Окр. белков в желтый цвет, если добавить аммиак - оранжевая окраска (ксантопротеиновая реакция). Обычно иссл. жидкость выпаривают с шерстяными нитками и шерсть (содержит белковое вещество) окрашивается в желтый цвет. Пикриновая кислота тоже окрашивает шерсть в желтый цвет, но при этом и раствор желтый. 2. С дифениламином в конц. серной кислоте (синяя окраска раствора) 3. Перегонка (в колбу добавляют медные опилки). Медь восстанавливает азотную кислоту до монооксида азота, который с кислородом дает NO2 (оранжевые пары диоксида азота). NO2 растворяется в воде с образованием HNO3 и HNO2: 3Cu + 2 HNO3 = 3CuO + 2NO + H2O 2NO + O2 = 2NO2 2NO2 + H2O = HNO2 + HNO3 4. С бруцином в конц. серной кислоте - красная окраска. Реакции с ДФА и бруцином мешает HNO2 – ее удаляют с помощью мочевины, NH4Cl, сульфаминовой кислоты: HOSO2NH2 + HNO2 = N2↑ + H2SO4 + H2O Хлороводородная кислота. Диализат исследуют с нитратом серебра. Если реакция положительна, то HCl отгоняют из дистиллята (свободная хлороводородная кислота отгоняется, а соли - нет). HCl отгоняется и когда отравление произошло от серной кислоты, т.к. серная кислота с хлоридами образует HCl. Поэтому сначала определяют H2SO4 в диализате. Реакции на HCl:1) с AgNO3 →AgCl (раств в NH4OH); 2) с хлоратом калия при нагревании выделяется Cl2 (синеет йодкрахмальная бумага): 6HCl + KClO3 = 3Cl2 + KCl + 3H2O Cl2 + 2KI = I2 + 2KCl Количественное определение хлороводородной кислоты проводят по методу Фольгарда или гравиметрическим методом, взвешивая хлорид серебра. Определение количества HCl необходимо, т.к. это позволяет судить, какая это кислота (введенная или содержащаяся в желудочном соке).
|
||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 779. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |