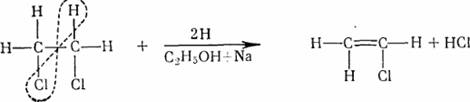Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Синильная кислота и ее соли. Токсикологическое значение, обнаружение и количественное определение.Синильная к-та (HCN) – газ или бесцветная жидкость, имеет запах горького миндаля, легко смешивается с водой и др. орг. растворителями. В свободном состоянии в природе синильная к-та не встречается. Она встречается в виде хим.соединений. Синильная к-та – слабая к-та, образует с Ме соли – цианиды. Синильная к-та и ее соли очень ядовиты. По токсичности синильная к-та превосходит многие известные яды. Смертельная доза синильной к-ты – 0,05-0,1 г., цианида калия – 0,15 – 0,25 г. Источники отравления – ядра горького миндаля, абрикоса, вишни. Изолирование синильной к-ты и цианидов из биоматериала производят перегонкой с водяным паром. При отравлении на хим.-токс. исследование берут желудок с содержимым, печень и почки. Реакции на синильную к-ту и ее соли проводят под тягой. Антидотом синильной к-ты являются альдегиды и кетоны (глюкоза, диоксиацетон). Р-ция образования берлинской лазури: HCN+NaOH→NaCN+H2O; 2NaCN+FeSO4→Fe(CN)2+Na2SO4; Fe(CN)2+4NaCN→Na4[Fe(CN)6] 3Na4[Fe(CN)6]+4FeCl3→Fe4[Fe(CN)6]3+12NaCl (синий ос-к или синяя окраска) Р-ция образования роданида железа: KCN+(NH4)2S2→KSCN+(NH4)2S; 3KSCN+FeCl3→Fe(SCN)3+3KCl (кроваво-красная окраска); Р-ция образования бензидиновой сини: 2HCN+Cu(CH3COO)2→Cu(CN)2+2CH3COOH; 2Cu(CN)2→(CN)2+2CuCN; (CN)2+H2O→O+2HCN;
(синее окрашивание индик.бумаги) Р-ция с пикриновой к-той: образуется соль изопурпуровой к-ты
+KCN+NaOH→ (красная окраска) 
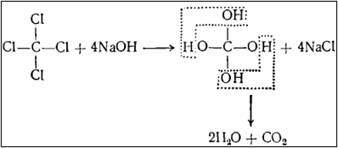
Колич. определение: 1. Титрим. метод (более 1 мг в 100 г биомассы): HCN+AgNO3→AgCN↓+HNO3; AgNO3+NH4NCS→AgNCS↓+NH4NO3; NH4NCS+NH4Fe(SO4)2→Fe(NCS)3+2(NH4)2SO4. Этот м-д нельзя применять при гнилостно-разложившемся объекте, т.к при гниении образуется H2S. 2. Весовой метод; 3. Фотоколориметрический метод. Четыреххлористый углерод, 1,2-дихлорэтан. Токсикологическое значение, изолирование и анализ. Реакции отличия четыреххлористого углерода от других галогенпроизводных. CCl4 – прозрачная, подвижная, тяжелая ж-ть с запахом хлороформа. Хороший р-ль жиров, смол. Исп-ся как консерви. ср-во для меховых изделий, при пожаротушении. Основные метаболиты – CHCl3 (хлороформ), СO2. Ядовит при вдыхании паров, как в жидком так и в парообразном виде. 1.Отщепление хлора: CCl4+4NaOH→4NaCl+CO2+2H2O; NaCl+AgNO3→AgCl↓+NaNO3: (белый растр. в NH3 осадок). 2.Образование изонитрила: CCl4+RNH2+KOH→RN=C+3KCl+3H2O (неприятный запах) В отличие от хлороформа и хлоралгидрата CCl4 не обладает способностью восстанавливать Cu(OH)2 в Cu2(OH)2 и Cu2O, т.к при кипячении его с едким натром не образуются в-ва, не обладающие восстановительным свойством:
3.Получение розового окрашивания с резорцином. 1,2 дихлорэтан (ClCH2-CH2Cl) – тяжелая, б/ц ж-ть с запахом хлороформа. Изолируют из биоматериала дистилляцией с водяным паром. Относится к наркотикам, поражает нервную систему ы вызывает заболевание почек и печени. Ядовит при вдыхании. Наблюдается рвота, понос, увеличение печени. 1. Отщепление водородным методом:
2. Образование этиленгликоля: C2H4Cl2+Na2CO3+H2O→C2H4(OH)2+2NaCl+CO2 при окислении дает формальдегид: С2H4(OH)2→2HCOH+H2O; 3. Нагревание с NaOH 40 %: С2H4Cl2+2NaOH→2NaCl+2H2O+C2H2; С2H2+2CuNO3+2NH4OH→C2Cu2+2NH4NO3+2H2O (розовый или красный цвет, осадок). Колич. опред. возможно по отщепленному с помощью металлического натрия в присуд. этилового спирта хлору. Опр-ся около 50 % хлора от теоретически вычисленного.
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 567. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |