
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Понятие об активности и фугитивностиФугитивность – величина, которую нужно подставить в выражение химического потенциала идеального газа, чтобы получить значение химического потенциала для реального газа. Величина фугитивности связана с парциальным давлением газа уравнением:
где Р – давление газа, γ – коэффициент фугитивности. Таким образом, величина фугитивности f включает в себя парциальное давление и поправку на неидеальность системы γ. Фугитивность имеет такую же размерность, как и давление. Ее величина не зависит от размерности давления. Коэффициент фугитивности величина безразмерная, величина коэффициента фугитивности в одних и тех же условиях состояния газа зависит от единиц измерения. Обычно коэффициент фугитивности меньше единицы. При увеличении давления газа коэффициент фугитивности уменьшается до какого-то предела, но затем может и увеличиваться. При больших давлениях, когда силы притяжения преобладают над силами отталкивания, коэффициент фугитивности может быть больше единицы. К использованию фугитивности на практике прибегают при давлениях в системе, больших 50 атм. При меньших давлениях при выполнении приближенных вычислений, определением фугитивности пренебрегают. С использованием справочных данных коэффициент активности можно определить, например, по методу соответственных состояний: при одинаковых параметрах все газы обладают приблизительно одинаковыми свойствами. Приведенный параметр – это отношение данного параметра (давления, температуры) к его критическому значению. Приведенное давление Приведенная температура Критические значения температуры и давления приводятся в справочной литературе.  Для определения коэффициента фугитивности пользуются специальными таблицами:
Активностью компонента раствора называется величина, которую нужно подставить в выражение для химического потенциала компонента (или другой характеристики) идеального раствора, чтобы получить действительное значение химического потенциала компонента (или другой величины) для неидеального раствора. Активность компонента связана с его концентрацией через величину коэффициента активности:
Химически потенциал компонента раствора не зависит от способа выражения концентрации раствора, однако величина стандартного химического потенциала будет связана со способом выражения концентрации раствора. Различают практический коэффициент активности, если концентрация выражена в моль/кг
молярный коэффициент активности, если концентрация выражена в моль/л
рациональный коэффициент активности, если концентрация выражена в мольных долях
Физический смысл коэффициента активности = величина = коэффициент активности показывает как отличаются концентрация и реальное поведение вещества в растворе = коэффициент активности учитывает процессы взаимодействия частиц компонентов раствора между собой, которые приводят к отклонению раствора от идеального.
Рис. 8. Зависимость активности и коэффициента активности от размености Константа равновесия При протекании химической реакции через некоторое время устанавливается равновесное состояние, при котором 1) состав системы с течением времени при постоянных внешних условиях не меняется. 2) если система, находящаяся в равновесии, будет выведена из этого равновесия каким-то внешним воздействием, то после прекращения этого воздействия система вернется к равновесному состоянию. Если внешние условия изменять на бесконечно малую величину, то положение равновесия тоже изменится на бесконечно малую величину. Химическую реакцию тогда можно представить как систему, которая проходит через ряд равновесных состояний – квазиравновесный процесс. При этом условии к химической реакции можно применять термодинамические соотношения, выведенные в приближении системы, находящейся в состоянии равновесия. Для решения четвертой задачи термодинамики о равновесном составе и выходе продукта реакции надо знать соотношение компонентов в равновесной системе, которое описывается законом действующих масс. Рассмотрим гомогенную реакцию, протекающую с участием идеальных газов
Для компонента идеальной газовой смеси
Для компонентов системы
Протекание процесса описывается уравнением
Если реализуется состояние равновесия, то
В состоянии равновесия с соответствии с законом Гесса
уравнение закона действующих масс. Замечание 1. Константу равновесия можно определить экспериментально, и из нее вычислить Замечание 2. константу равновесия можно вычислить по справочным данным
Замечание 3. Закон действующих масс можно записать через парциальные давления: мольные доли: молярную концентрацию: Замечание 4. Величины KP, Kx и KC связаны между собой соотношением
Замечание 5. Величина Kx – безразмерная, Замечание 6. Если давление выражено в атмосферах, то KP = K0 Замечание 7. Для неидеальных систем в формуле закона действующих масс следует использовать понятие фугитивности. Для определения состава системы при установившемся равновесии и выхода продукта реакции необходимо знать константу равновесия и состав исходной смеси. |
||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 746. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 ,
, ;
;
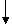 π
π
 τ
τ
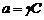 или
или 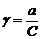
 ;
;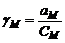
 .
.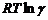 представляет собой работу переноса 1 моль растворенного вещества из идеального раствора в реальный той же концентрации
представляет собой работу переноса 1 моль растворенного вещества из идеального раствора в реальный той же концентрации

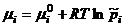
 ;
;  ;
;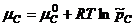 ;
; 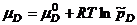 .
.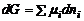 или
или 
 или
или  или
или 




 или
или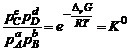
 по уравнению:
по уравнению: 
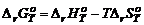
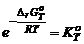




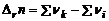 , где
, где  – стехиометрические коэффициенты при газообразных продуктах реакций,
– стехиометрические коэффициенты при газообразных продуктах реакций, 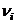 – стехиометрические коэффициенты при газообразных исходных веществах.
– стехиометрические коэффициенты при газообразных исходных веществах. ,
, 