
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Активности в растворах электролитов, методы их расчетаЧтобы не усложнять термодинамические соотношения, выведенные для идеальных растворов, Льюис предложил использовать в термодинамических соотношениях вместо концентрации активность. Активность компонента связана с его концентрацией в растворе через коэффициент активности g: Для растворов электролитов коэффициент активности связан с величиной ионной ассоциации. Чем сильнее ионная ассоциация в растворе, тем ниже коэффициент активности. Ионная ассоциация усиливается с ростом концентрации электролита в растворе и с увеличением заряда ионов. Если между ионами нет химического взаимодействия, то степень ассоциации ионов определяется ионной силой раствора. Ионной силой называют полусумму произведений моляльных концентраций всех ионов в растворе на квадраты их зарядов:
Чем выше ионная сила раствора, тем ниже коэффициент активности. При этом в растворах с одинаковой ионной силой среднеионные коэффициенты активности в первом приближении совпадают. В предельно разбавленном растворе ионная ассоциация отсутствует и коэффициент активности равен единице, т.е. активность равна концентрации. В рамках теории Дебая-Хюккеля для расчета среднеионного коэффициента активности вещества в водном растворе применяется одно из двух уравнений:
при ионной силе раствора менее 0,05 моль/кг и
при ионной силе раствора от 0,05 до 0,5 моль/кг, где Теория Дебая-Хюккеля предполагает возможность расчета коэффициента активности отдельного иона по уравнениям
 Фазовые равновесия Основные понятия Фаза – совокупность гомогенных частей системы, одинаковых по составу, физическим и химическим свойствам, и отделенных от других частей системы поверхностью. Составляющее вещество – каждое вещество, которое может быть выделено из системы и существовать вне ее. Компоненты системы (независимые составляющие вещества) – набор составляющих веществ, концентрации которых в данной системе могут быть выбраны произвольно без изменения числа фаз системы. Число компонентов системы – наименьшее число составляющих веществ, достаточное для определения состава любой фазы системы. Число компонентов равняется числу составляющих веществ системы за вычетом числа уравнений, связывающих концентрации этих веществ на момент равновесия. Таким образом, число компонентов системы или совпадает с числом составляющих веществ или меньше его. Если между составляющими веществами отсутствует химическое взаимодействие, то уравнений связи нет и число компонентов равно числу составляющих веществ Правило фаз Гиббса Пусть есть система, которая содержит число фаз Ф и число компонентов K. Компоненты системы присутствуют во всех фазах. Для описания состояния такой системы нужна информация о температуре, давлении и составе (химических потенциалах компонентов). Для описания состава каждой фазы необходимо и достаточно указать концентрации (K–1) компонентов. Содержание последнего указывать не обязательно, т.к. оно получается по разности (очевидно). Для описания состава всех фаз нужно Ф(K–1) переменных. Для описания состояния системы в целом нужно Ф(K–1)+2 переменных (цифра 2 относится к переменным температура и давление). Число Ф(K–1)+2 – общее количество переменных. Состояние равновесия характеризуется равенством химических потенциалов компонентов во всех фазах системы. Например, для системы из двух фаз α и β:
Для системы из Ф фаз и K компонентов:
Получается система из K(Ф–1) уравнений и тогда число независимых переменных (степеней свободы): Ф(K–1)+2 – K(Ф–1) = ФK – Ф + 2 – KФ + K = K – Ф + 2 Уравнение
Число степенней свободы равновесной термодинамической системы, на которую влияют только температура и давление, равно числу независимых компонентов системы минус число фаз + 2. Число степеней свободы характеризует вариантность системы, т.е. число независимых переменных (давление, температура, состав), которые можно свободно менять в определенных пределах и при этом число и природа фаз останутся без изменений. Увеличение числа компонентов системы приводит к росту числа степеней свободы. Увеличение числа фаз приводит к уменьшению степеней свободы. Если число степеней свободы F = 0, то такая система называется безвариантной. Безвариантной системе соответствует максимально возможное количество фаз, находящихся в равновесии. Если число степеней свободы F = 1, то такая система называется моновариантной. возможно изменение только одного параметра. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 391. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
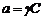 .
.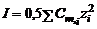 .
.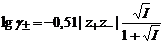
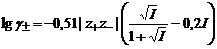
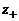 и
и 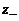 – заряд катиона и аниона.
– заряд катиона и аниона.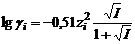 при ионной силе раствора менее 0,05 моль/кг и
при ионной силе раствора менее 0,05 моль/кг и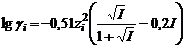 при ионной силе раствора от 0,05 до 0,5 моль/кг, где
при ионной силе раствора от 0,05 до 0,5 моль/кг, где 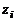 – заряд отдельного иона.
– заряд отдельного иона.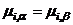 .
.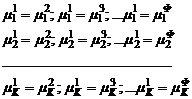
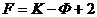 – уравнение правила фаз Гиббса
– уравнение правила фаз Гиббса