
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Термодинамические потенциалыНа практике используются системы закрытые либо открытые. Следовательно, необходим вывод критерия, который бы отвечал двум требованиям: 1) позволял прогнозировать направление протекания процесса в любых условиях его проведения; 2) его можно было вычислить исходя из термодинамических характеристик системы. В качестве подобного критерия была разработана система термодинамических потенциалов. Термодинамический потенциал – максимальная работа, которую может совершить система при обратимом протекании процесса в данных условиях. Тогда если система совершает по ходу процесса работу, меньшую, чем максимальная, то такой процесс идет самопроизвольно: Для вывода термодинамических потенциалов используют формулу, объединяющую первый и второй закон термодинамики:
где При V,T = const
Термодинамическая функция F=U – TS называется функцией Гелъмголъца, или изохорно-изотермическим потенциалом. Поскольку эта функция образована из функций состояния U и S, она также является функцией состояния. Очевидно, что для протекания процесса необходимо условие Таким образом, с приближением системы к состоянию равновесия изохорно-изотермический потенциал убывает, достигая минимума в состоянии равновесия. При Р,T = const W = 0.
Термодинамическая функция G = H – TS называется функцией Гиббса, или изобарно-изотермическим потенциалом. Поскольку эта функция образована из функций состояния U и S, она также является функцией состояния. Очевидно, что для протекания процесса необходимо условие  Химическое равновесие |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 326. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 или состояние равновесия
или состояние равновесия  .
.
 - это количество теплоты, выраженное через энтропию.
- это количество теплоты, выраженное через энтропию.

 , а для равновесия
, а для равновесия 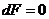 .
.



 , а для равновесия
, а для равновесия  .
.