
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Вычисление константы равновесия по уравнению изобары химической реакцииХимическая термодинамика позволяет определить константу равновесия при какой-либо температуре, если известны константы равновесия при другой температуре и тепловой эффект реакции. Реакция:
– уравнение изобары химической реакции в дифференциальной форме. На практике пользуются интегральной формой уравнения изобары химической реакции:
Следствие 1 Для эндотермической реакции Для экзотермической реакции Следствие 2 Уравнение Свойства растворов Закон Рауля Физический смысл закона Рауля состоит в том, что растворяя какое-либо вещество в данном растворителе, мы понижаем его концентрацию в единице объема, и тем самым понижаем давление пара растворителя над раствором. В результате чего равновесие между жидкостью и паром должно устанавливаться при меньшей концентрации пара, т. е. при меньшем давлении пара растворителя:
Для бинарного раствора закон Рауля формулируют следующим образом: относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества в растворе.
Закон Рауля применим к растворителю в предельно разбавленных и идеальных растворах и к растворенному веществу только в идеальных растворах.  Растворимость газов В ситуации предельно разбавленного раствора для определения растворимости вещества применяют закон Генри:
Константа Генри (приводимая в справочниках по термодинамическим свойствам веществ) не является свойством только растворенного вещества или растворителя. Она является свойством данного раствора и должна определяться экспериментально на основе исследования летучести хотя бы при одной концентрации. Из уравнения закона Генри следует, что
Уравнение Генри часто используют для оценки растворимости газов. В этом случае концентрацию насыщенного раствора При оценке растворимости газов в электролитах пользуются эмпирическим уравнением Сеченова:
где S – растворимость газа в растворе электролита, K – эмпирический коэффициент, С – концентрация раствора электролита S0 – растворимость газа в чистом растворителе (например, в воде). Уравнение Шредера Твердые вещества не могут беспредельно растворяться в жидкостях. При достижении определенной концентрации растворение прекращается. Устанавливается равновесие между твердой и жидкой фазами. Раствор, находящийся в равновесии с твердым веществом, называется насыщенным. Приближение идеального раствора Если растворяемое вещество твердое, то теплота растворения = теплоте плавления:
Это уравнение было эмпирически получено Шредером в 1890 г. и носит его имя. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 421. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 , протекающая в газовой фазе. Приближение идеального газа.
, протекающая в газовой фазе. Приближение идеального газа.
 не зависит от давления, но зависит от температуры. Воспользуемся уравнением Гиббса-Гельмгольца:
не зависит от давления, но зависит от температуры. Воспользуемся уравнением Гиббса-Гельмгольца: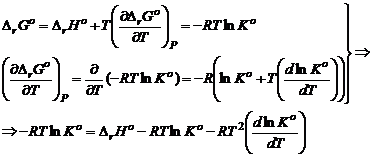

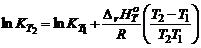
 равновесие смещается в сторону прямой реакции
равновесие смещается в сторону прямой реакции равновесие смещается в сторону обратной реакции
равновесие смещается в сторону обратной реакции . Тогда по тангенсу угла наклона зависимости lnK = f(T−1) можно определить тепловой эффект реакции:
. Тогда по тангенсу угла наклона зависимости lnK = f(T−1) можно определить тепловой эффект реакции: 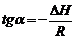




 выражают в объемных единицах (V), например, в м3/л.
выражают в объемных единицах (V), например, в м3/л.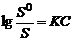 ,
,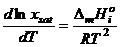 или
или 