
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Парциальные молярные величиныДля описания изменения экстенсивных свойств системы в зависимости от ее состава используют функцию парциальной молярной величины. Физический смысл функции ПМВ - изменение экстенсивного свойства системы, содержащей очень большое количество вещества при добавлении к ней одного моля компонента при постоянных температуре, давлении и составе. В силу того, что ПМВ – это изменение свойства, значения ПМВ могут быть любыми. Например, ПМ объем системы может оказаться величиной отрицательной. Символом п. м. свойства является горизонтальная черта над буквенным обозначением свойства. Нижний индекс обозначает номер компонента раствора, причем номер 1 обычно присваивается растворителю. Математически ПМВ – это производная экстенсивного свойства системы по числу молей какого-либо ее компонента при постоянстве всех остальных параметров – давления, температуры, состава (по всем остальным компонентам).
Любое общее свойство системы складывается из набора парциальных мольных свойств. ПМВ является долей экстенсивного свойства системы, приходящейся на 1 моль вещества в системе данного состава:
– первое уравнение Гиббса-Дюгема. Для чистого вещества ПМВ совпадает с просто экстенсивным свойством.
– второе уравнение Гиббса-Дюгема. При помощи ПМВ можно применить к системе переменного состава весь математический аппарат химической термодинамики. Это дает возможность выразить через термодинамические уравнения любые равновесные свойства системы. Химический потенциал Изменение состава системы не может не сказываться на характере протекания процесса, например, на положении химического равновесия. Возникает вопрос учета влияния переменного состава на основные показатели реакции, основным из которых является энергия Гиббса.  Т.к. G – экстенсивная величина, то ее частная производная по числу моль является парциальной молярной величиной:
Парциальная молярная энергия Гиббса получила название «химический потенциал». Химический потенциал компонента равен изменению энергии Гиббса при добавлении 1 моль этого компонента к большому объему системы в изобарно-изотермическом процессе, при условии, что состав системы остается постоянным:
Протекание процесса зависит от величины химического потенциала. Чтобы процесс шел в нужном направлении должно соблюдаться условие уменьшения химического потенциала:
Условие равновесия: По свойству ПМВ (I уравнение Гибба-Дюгема):
и можно вычислить изменение энергии Гиббса при любом составе. Согласно закону Гесса:
Химический потенциал идеального газа равен его энергии Гиббса
где μ* – постоянная интегрирования. Для определения μ* используют представление о т.н. стандартном состоянии (P = 1 атм., Т = 298 K), с учетом которого
где Изменение химического потенциала
Если будет смесь идеальных газов, то для компонента смеси:
В ситуации реального газа необходимо учитывать взаимодействие молекул газа друг с другом, которое учитывают, используя понятие фугитивности в уравнении химического потенциала идеального газа:
В обоих уравнениях Изменение химического потенциала неидеального газа:
Химический потенциал компонента идеального раствора описывается дифференциальным уравнением
где хi – мольная доля компонента в растворе. После решения дифференциального уравнения получается интегральная форма:
где Изменение химического потенциала компонента идеального раствора
Дифференциальное уравнение химического потенциала компонента неидеального раствора согласно Льюису:
и выражение химического потенциала:
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 769. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 или
или 

 .
.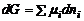 .
. , что равносильно
, что равносильно  или
или 
 .
.
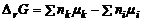 .
. или в дифференциальной форме при T = const и количестве вещества газа один моль
или в дифференциальной форме при T = const и количестве вещества газа один моль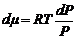 откуда
откуда 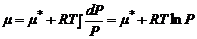 ,
,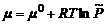 ,
, – стандартный химический потенциал,
– стандартный химический потенциал,  – относительное давление;
– относительное давление;  – отношение текущего парциального давления идеального газа к его давлению в стандартных условиях. Относительное давление – величина безразмерная, но численно относительное давление равно парциальному давлению газа, выраженному в атмосферах.
– отношение текущего парциального давления идеального газа к его давлению в стандартных условиях. Относительное давление – величина безразмерная, но численно относительное давление равно парциальному давлению газа, выраженному в атмосферах.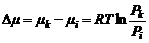
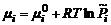 и
и
 для однокомпонентной системы
для однокомпонентной системы для смеси неидеальных газов
для смеси неидеальных газов =1, а f0 = Р0);
=1, а f0 = Р0);  , где f0 – стандартная фугитивность – фугитивность газа в стандартном состоянии, относительная фугитивность численно равна фугитивности, выраженной в атмосферах.
, где f0 – стандартная фугитивность – фугитивность газа в стандартном состоянии, относительная фугитивность численно равна фугитивности, выраженной в атмосферах. для однокомпонентной системы
для однокомпонентной системы для смеси неидеальных газов.
для смеси неидеальных газов. ,
, ,
,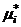 – химический потенциал чистого компонента раствора;
– химический потенциал чистого компонента раствора; 


 – относительная активность компонента неидеального раствора,
– относительная активность компонента неидеального раствора,  , где
, где 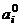 –активность вещества в стандартном состоянии; по величине
–активность вещества в стандартном состоянии; по величине  . Обычно активность вещества в стандартном состоянии принимают равной 1.
. Обычно активность вещества в стандартном состоянии принимают равной 1.