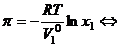Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Температура кипения раствораЧистый растворитель (или раствор) начнет кипеть при такой температуре, при которой давление пара растворителя над чистым растворителем или раствором будет равно внешнему давлению Р. Из закона Рауля следует, что давление насыщенного пара растворителя над раствором меньше давления насыщенного пара растворителя над ним самим, следовательно, температура кипения раствора будет больше, чем чистого растворителя. Разность температур кипения характеризует повышение температуры кипения раствора:
Для летучего компонента идеального раствора дифференциальная теплота растворения равна теплоте испарения, взятой с обратным знаком:
Для бинарного раствора, содержащего летучий растворитель и нелетучее растворенное вещество: с ростом мольной доли растворенного вещества х2 уменьшается доля растворителя (1–х2), соответственно увеличивается температура кипения раствора:
Для бинарного раствора с летучим растворителем:
Все уравнения, выведенные для идеального раствора справедливы для растворителя. Температура замерзания раствора При кристаллизации (обратный процесс – плавление) для каждого из компонентов системы реализуется равновесие:
Для компонента идеального раствора будет справедливо:
 Для бинарного раствора: с ростом мольной доли растворенного вещества х2 уменьшается доля растворителя (1–х2), соответственно уменьшается температура кристаллизации раствора
Для бинарного раствора с летучим растворителем:
При образовании твердого раствора:
где Все уравнения, выведенные для идеального раствора справедливы для растворителя в предельно разбавленном растворе. Осмотическое давление При наличии разности химических, потенциалов между участками одной фазы или между разными фазами компоненты системы диффундируют в направлении падения своих химических потенциалов до тех пор, пока эта разность не будет ликвидирована, т. е. пока не установится равновесие. Таким образом, необходимым условием для достижения подобного равновесия является возможность свободного и беспрепятственного перехода всех компонентов системы из одной фазы в другую, из одного участка в другой. Если же отдельные части системы разделены перегородками, которые непроницаемы для некоторых компонентов, то сосуществующие фазы могут находиться при разных давлениях, а равенство химических, потенциалов установится только для тех компонентов, которые могут беспрепятственно переходить через перегородку (мембрану). Так, если сосуд перекрыт мембраной, по одну сторону которой находится, например, водный раствор какого-либо вещества, а по другую – чистый растворитель (вода), то вода будет переходить в ту часть сосуда, в которой находится раствор, если мембрана проницаема для молекул воды. Такой переход через мембрану называется осмосом, а сила, приходящаяся на единицу площади и заставляющая растворитель переходить через перегородку в раствор называется осмотическим давлением:
– уравнение Вант-Гоффа. Т.к. уравнение Вант-Гоффа выведено для растворителя, то оно справедливо для ситуации предельно разбавленного раствора. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 466. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 – дифференциальная теплота растворения паров компонента в растворе данного состава при температуре кипения или изменение парциальной молярной энтальпии летучего компонента при образовании раствора из пара этого компонента
– дифференциальная теплота растворения паров компонента в растворе данного состава при температуре кипения или изменение парциальной молярной энтальпии летучего компонента при образовании раствора из пара этого компонента


 – температура кипения чистого летучего компонента (для бинарной системы - растворителя);
– температура кипения чистого летучего компонента (для бинарной системы - растворителя);  – температура кипения раствора.
– температура кипения раствора.
 .
. , значение
, значение  :
: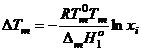

 ,
, – мольная доля растворителя в жидком растворе,
– мольная доля растворителя в жидком растворе,  – мольная доля растворителя в твердом растворе. Если
– мольная доля растворителя в твердом растворе. Если 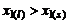 , то температура замерзания чистого растворителя может быть меньше температуры замерзания раствора.
, то температура замерзания чистого растворителя может быть меньше температуры замерзания раствора.