
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Расчет тепловых эффектов химических реакций. Закон ГессаСтр 1 из 62Следующая ⇒ Термодинамика Предмет и задачи термодинамики Термодинамика в своей основе – наука о превращениях теплоты в работу и обратно. Названа от греческого слова «терме» (теплота) и «динамис» (сила, работа). 1. Расчет тепловых эффектов, количества теплоты и тепловых балансов. 2. Расчет возможности протекания и направления протекания процесса. 3. Расчет равновесного состава системы. 4. Расчет условий проведения процесса.
Рис. 2. Задачи термодинамики Основные понятия термодинамики Термодинамическая система – тело или группа тел, выделенная мысленно из окружающей среды. Термодинамические системы условно подразделяют на следующие виды
Рис. 3. Типы термодинамических систем Термодинамическое состояние системы – это совокупность всех ее свойств (физических и химических).
Рис. 4. Классификация свойств систем Все свойства системы (вещества) подразделяются на два класса: интенсивные и экстенсивные. Интенсивные свойства термодинамической системы называются термодинамическими параметрами состояния системы. Наиболее удобными параметрами состояния системы являются температура, давление, плотность (удельный объем) тела. Внутренняя энергия состоит из энергии различных форм движения микрочастиц: поступательного движения молекул Uпост, вращательного движения молекул и их фрагментов Uвращ., колебательного движения атомов и групп атомов в молекуле Uколеб., движения электронов в атоме Ue, движения нуклонов в ядре атома Uя.
С увеличением массы системы пропорционально ей растет и внутренняя энергия, т.к. она является экстенсивным свойством системы.  Внутренняя энергия является термодинамическим свойством и функцией состояния системы. Изменение внутренней энергии не зависит от того, через какие промежуточные стадии идет процесс, а определяется только исходным и конечным состояниями системы. Абсолютное значение внутренней энергии не может быть определено. В связи с этим при расчетах всегда пользуются изменением внутренней энергии
где Система может обмениваться энергией с окружающей средой двумя путями: 1) теплота (энергия, передаваемая одним телом другому, зависящая от температуры) 2) работа (форма обмена энергией, от температуры не зависящая). Для теплоты и работы используется две системы знаков: термодинамическая (со стороны системы, преимущественно используется) и эгоистическая (со стороны наблюдателя, устаревшая)
Теплота и работа не являются функциями состояния и не являются свойством системы, о них можно говорить только в связи с процессом и во время процесса. Максвелл, по-видимому, первый охарактеризовал работу как упорядоченное движение, а теплоту как передачу беспорядочного движения. Первый закон термодинамики При помощи первого начала решается первая задача термодинамики – расчет теплового эффекта, количества теплоты, теплового баланса. Математически первое начало термодинамики:
Изменение внутренней энергии системы равно сумме количества выделившейся или поглощенной теплоты и совершенной системой работы В уравнении перед символами теплоты Q и работы W стоит знак δ, отображающий некие конечные приращения этих величин, а перед символом U – внутренней энергии – знак d, свидетельствующий о том, что внутренняя энергия является функцией состояния, которая не зависит от пути процесса. Если учитывать только работу расширения газа dW = PdV, то первое начало термодинамики можно записать в виде:
В изохорном процессе V = const, следовательно dV = 0, следовательно
Вся теплота расходуется на изменение внутренней энергии системы и приобретает свойства функции состояния. В изобарном процессе P = const, следовательно,
Величина
называется энтальпией, обозначается H. Является расширенной внутренней энергией системы, т.к. непосредственно связана с внутренней энергией и является полным дифференциалом, следовательно она – функция состояния. Следовательно, количество теплоты при изобарном процессе – тоже функция состояния. При изобарном процессе теплота расходуется на совершение работы и изменение внутренней энергии системы. В изотермическом процессе
Следовательно,
Вся теплота идет на совершение работы. В данном случае – работы расширения. По уравнению Менделеева-Клапейрона (для 1 моль газа)
Выражения для зависимости теплоты и работы от параметров системы – давления P, объема V и температуры Т для основных состояний идеального газа приведены в таблице:
Теплоемкость Средней теплоемкостью системы называют количество тепла, отнесенное к вызванному им повышению температуры системы:
Если эта величина отнесена к единице массы, говорят об удельной теплоемкости, если к молю – о молярной теплоемкости.
Рис. 5. Виды теплоемкости по размерности Так как теплоемкость довольно существенно меняется с изменением температуры, обычно используют и табулируют не среднюю теплоемкость, зависящую как от исходной температуры Тi так и от конечной Тk а производную от теплоты по температуре, называемую истинной или просто теплоемкостью:
Рис. 6. Разница между понятием истинной и средней теплоемкости Обычно в процессах изобарного или изохорного нагревания используют изобарную (Ср) или изохорную (Сv) теплоемкость.
Рис. 7. Изохорная и изобарная теплоемкости
На основе этих определений можно рассчитать количество теплоты, необходимое для изобарного нагревания 1 моль вещества от температуры Т1 до Т2:
Так как при изобарном нагревании теплота расходуется не только на увеличение внутренней энергии, но и на совершение работы расширения, Ср практически всегда больше Сv:
Конденсированные тела (жидкости и кристаллы) расширяются при нагревании приблизительно на порядок меньше, чем газы. Поэтому при грубых оценках разностью между Сp и Cv просто пренебрегают или принимают ее равной 1 Дж/мольК. В инженерных расчетах обычно имеют дело с изобарной теплоемкостью, в то время как теоретические соображения чаще приводят к изохорной теплоемкости, которую затем пересчитывают в изобарную. Температурную зависимость экспериментально полученных значений теплоемкости Ср в зависимости от температурного диапазона описывают степенными рядами Келли:
где верхний индекс Ср означает стандартные условия (Р = 1,013∙105 Па, т. е. атмосферное давление); а, b, с и с' -эмпирические коэффициенты, обычно для неорганических веществ с = 0, а для органических с' = 0. Расчет тепловых эффектов химических реакций. Закон Гесса При отсутствии полезной работы, теплота подводимая к системе, расходуется только на увеличение, внутренней энергии (V = const) или энтальпии (P = const).
Закон Гесса: «Тепловой эффект химической реакции не зависит от пути процесса, а определяется лишь состоянием исходных и конечных веществ в ней участвующих» Закон Гесса широко применяется для вычисления тепловых эффектов химических реакций. Тепловой эффект химической реакции равен разности сумм энтальпий образования конечных и исходных веществ.
Энтальпией образования называют изменение энтальпии (тепловой эффект при Р = cоnst) при образовании одного моля данного вещества из простых веществ в устойчивых состояниях. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 337. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |



 .
. ,
, ,
,  – значение внутренней энергии конечного и исходного состояний системы.
– значение внутренней энергии конечного и исходного состояний системы. или
или 
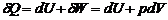 .
. или
или  .
. .
.
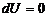 , т.к. T = const.
, т.к. T = const. или
или  .
. отсюда
отсюда 





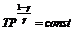








 .
.
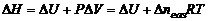 , где
, где .
.