
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
LS-связь; связь Рассела-СаундерсаСхема построения волновых функций атомных состояний, основанная на представлении, что орбитальные моменты атомных электронов складываются в орбитальный момент атома L, а их спиновые моменты - в спин атома S, которые и взаимодействуют между собой
Правила отбора. Спектры атомов Знаем, что испускание и поглощение света происходит при переходах электрона с одного уровня на другой. При этом атом может поглотить или испустить только фотон с энергией, равной разности энергий соответствующих уровней. А поскольку фотон обладает собственным моментом импульса, то переходы могут осуществляться только между такими энергетическими уровнями, для которых будет справедлив закон сохранения момента импульса системы «фотон-электрон». Это сводится к так называемым правилам отбора: электрон может совершить только такой переход, при котором орбитальное и магнитное квантовые числа меняются на единицу:
Все разрешенныеэтими правилами переходы составляют спектр поглощения (для переходов с увеличениемl) или спектр излучения (для переходов с уменьшениемl). Переходы с изменением mlтакже будут происходить, но поскольку это квантовое число практически не влияет на значение энергии соответствующего состояния, то по величине энергии различить между собой эти переходы невозможно (по крайней мере в отсутствие сильных магнитных полей).
Принцип тождественности. Симметричные и антисимметричные волновые функции системы тождественных частиц. Принцип Паули. Распределение электронов в атоме по состояниям и порядок заполнения электронами электронных оболочек и подоболочек в многоэлектронном атоме.  Принцип тождественности – фундаментальный принцип квантовой механики, согласно которому состояния системы частиц, получающиеся друг из друга перестановкой тождественных частиц местами, нельзя различить ни в каком эксперименте. Такие состояния должны рассматриваться как одно физическое состояние. Этот принцип – одно из основных различий между классической и квантовой механикой. В классической механике всегда можно проследить за движением отдельных частиц по траекториям и таким образом отличить частицы одну от другой. В квантовой механике тождественные частицы полностью лишены индивидуальности. Эмпирическим фактом, который и составляет сущность принципа тождественности, является то, что в природе различают лишь два класса волновых функций для систем тождественных частиц: симметричные волновые функции, у которых при перестановке пространственных и спиновых координат любой пары тождественных частиц волновая функция не изменяется, и антисимметричные волновые функции, при аналогичной перестановке изменяющие знак. Функции, сохраняющие свое значение при перестановке аргументов, называются симметричными: Принцип тождественности и вытекающие из него требования симметрии волновых функций для системы тождественных частиц приводят к важнейшему квантовому эффекту, не имеющему аналога в классической теории, – существованию обменного взаимодействия. Одним из первых успехов квантовой механики было объяснение немецким физиком В. Гей-зенбергом (1901–1976) наличия двух состояний атома гелия – орто- и парагелия, основанное на принципе тождественности. Принцип Паули, который часто называют еще принципом запрета, ограничивает число электронов, которые могут находиться на одной орбитали. Согласно принципу Паули, на любой орбитали может находиться не более двух электронов и то лишь в том случае, если они имеют противоположные спины (неодинаковые спиновые числа). Поэтому в атоме не должно быть двух электронов с одинаковыми четырьмя квантовыми числами (n, l, ml, ms). Считается, что электрон(е) в атоме занимает свою электронную орбиталь. По КМТ под электронной орбиталью понимают область пространства около ядра, где наиболее вероятно нахождение электронной плотности. Эту область пространства называют электронным облаком. Электрон.облако располагается в 3х-мерном пространстве и для полной его характеристики используют 4 квантовых числа. 1-3 характеризуютют форму электронного облака и его расположение в пространстве около ядра, а 4 характеризует собств. состояние электронов. n – главное квантовое число,хар-етосн. запас энергии е. Чем больше n, тем больше запас энергии е, тем дальше е от ядра и тем больше размер электронного облака. Может изменяться от 1 до ∞ (1,2,3…∞). У элементов периодической системы n изм. от 1 до 7. Характеризует энергетич. ур-нь е и совпадает с № периода элемента ПС Менделеева. l – орбитальное квантовое число,хар-еторбитальн. момент кол-ва движения и определяет форму электронного облака.l= n-1 l изменяется от 0 до n-1 (0,1,2…). Хар-етэнергетич. подуровень, обознач.латинскими буквами. Каждый энергетич. подуровень имеет определенную форму электронного облака. l = 0, S-подуровень, l = 1, P-подуровень,l = 2, D-подуровень, l = 3,F-подуровень. ml- магнитное квантовое числоmlхар-ет ориентацию электрон.облака по отнош. к внешн. магнитному полю. mlхарактеризуется от +l..0..-l, принимая все целочисленные значения. Если l=0, то ml=0, если l=0, то ml=+1..0..-1. Магнитн. квант.число показывает число орбиталей: ml=2l+1 принцип минимума:С увеличением заряда ядра каждый новый е помещается на свободн. подуровень с наим. энергией. принцип Паули: в одном атоме не может быть двух е с одинаковыми 4 квантовыми числами. правило Хунда: при заполнении подуровня, е стремится иметь max спин или быть неспаренным.
Рентгеновское излучение. Рентгеновская трубка. Сплошной спектр тормозного рентгеновского излучения и его коротковолновая граница. Характеристическое рентгеновское излучение и его линейчатый спектр. Закон Мозли. Рентгеновское излучение, с точки зрения физики, это электромагнитное излучение, длина волн которого варьируется в диапазоне от 0,001 до 50 нанометров. Было открыто в 1895 немецким физиком В.К.Рентгеном. По природе эти лучи являются родственными солнечному ультрафиолету. В спектре солнечного луча самыми длинными являются радиоволны. За ними идет инфракрасный свет, который наши глаза не воспринимают, но мы ощущаем его как тепло. Далее идут лучи от красного до фиолетового. Затем – ультрафиолет (А, В и С). А сразу за ним рентгеновские лучи и гамма-излучение. Самый распространенный источник такого излучения - рентгеновская трубка. Испускаемое ей излучение неоднородно. В нем присутствует и мягкое (длинноволновое), и жесткое (коротковолновое) излучения. Мягкое характеризуется тем, что полностью поглощается человеческим телом, поэтому такое рентгеновское излучение вред приносит в два раза больше, чем жесткое. При чрезмерном электромагнитном облучении в тканях организма человека ионизация может привести к повреждению клеток и ДНК. Трубка - это электровакуумный прибор с двумя электродами – отрицательным катодом и положительным анодом. При разогревании катода из него испаряются электроны, затем они ускоряются в электрическом поле. Сталкиваясь с твердым веществом анодов, они начинают торможение, которое сопровождается испусканием электромагнитного излучения. По способу возбуждения рентгеновское излучение подразделяют на тормозное и характеристическое. Тормозным называется рентгеновское излучение, возникающее в результате торможения электронов электростатическим полем атомных ядер и атомарных электронов вещества анода рентгеновской трубки (имеет сплошной спектр). Согласно классической электродинамике при торможении электрона должны возникать излучения всех длин волн от нуля до бесконечности. Длина волны, на которую приходится максимум мощности излучения, должна уменьшиться по мере увеличения скорости электронов. Однако есть принципиальное отличие от классической теории: нулевые распределения мощности не идут к началу координат, а обрываются при конечных значениях – это и есть коротковолновая граница рентгеновского спектра. Характеристическое излучение вызывается при переходах электронов, находящихся во внутренних слоях атомов. Для этого необходима энергия возбуждения, порядка 104-105 эВ. Электрон с какой-либо из электронных оболочек переходит на достаточно далекий возбужденный уровень. При этом с более высокого энергетического уровня на освободившееся место может перейти электрон, излучая фотон с частотой, равной разности уровней энергии перехода. Свободное место может образоваться на любой из оболочек K,L,M и т.д., а переход электрона может происходить с более высоких уровней (оболочек). Этот процесс сопровождается излучением, состоящим из множества фотонов и имеющее линейчатый спектр. Возникновение некоторых серий характеристического излучения показано на рисунке 1.
Рисунок 1. К – серия, высокочастотная, самая жесткая. В пределах этой серии линия Кα является наиболее мягкая. Серии L и М являются более мягкие. Жесткость рентгеновского излучения растет с увеличением заряда атомного ядра, т.е. с увеличением атомного номера элемента. Эта зависимость выражена законом Мозли (1913 г. англ. физик). «Корень квадратный из частоты ν, соответствующей данной линии характеристического рентгеновского излучения, является линейной функцией атомного номера Z элемента: где a и b – постоянные величины.
32. Основная задача квантовых статистик. Бозоны и фермионы. Шестимерное фазовое пространство (x, y, z, px, py, pz). Число фазовых ячеек (число квантовых состояний), энергия которых заключена в интервале отЕдо Е+dЕ. Распределение Бозе – Эйнштейна и Ферми – Дирака. Квантовая статистика — раздел статистической физики, исследующий системы, которые состоят из огромного числа частиц, подчиняющихся законам квантовой механики. В отличие от исходных положений классической статистической физики, в которой тождественные частицы различимы (частицу можно отличить от всех таких же частиц), квантовая статистика основывается на принципе неразличимости тождественных частиц. При этом оказывается, как будет показано ниже, что коллективы частиц с целым и полуцелым спинами подчиняются разным статистикам. Пусть система состоит из N частиц. Введем в рассмотрение многомерное пространство всех координат и импульсов частиц системы. Тогда состояние системы определяется заданием 6N переменных, так как состояние каждой частицы определяется тройкой координат х, у, z и тройкой соответствующих проекций импульса px,pу, pz. Соответственно число «взаимно перпендикулярных» координатных осей данного пространства равно 6N. Это 6N-мерное пространство называется фазовым пространством. Каждому микросостоянию системы отвечает точка в бN-мерном фазовом пространстве, так как задание точки фазового пространства означает задание координат и импульсов всех частиц системы. Разобьем фазовое пространство на малые бN-мерные элементарные ячейки объемом dqdp=dq1 dq2...dq3N dp1 dp2...dp3N, где q — совокупность координат всех частиц, р— совокупность проекций их импульсов. Корпускулярно-волновой дуализм свойств вещества и соотношение неопределенностей Гейзенберга приводят к выводу, что объем элементарной ячейки (он называется фазовым объемом) не может быть меньше чем h3(h — постоянная Планка). Распределение частиц. Зная число
где g — числовой коэффициент порядка единицы, он связан со спецификой частиц идеального газа. Согласно квантовой теории все микрочастицы подразделяют на два класса, которым соответствуют две квантовые статистики: 1. частицы с полуцелым спином, их называют фермионами; они подчиняются статистике Ферми-Дирака; 2. частицы с целым спином — бозоны; они подчиняются статистике Бозе-Эйнштейна. Квантовые распределения. Эти распределения представляют собой функции для фермионов для бозонов Здесь m - так называемый химический потенциал (некоторая характерная энергия, значение которой можно найти из условия нормировки: суммарное число частиц во всех фазовых ячейках должно быть равно полному числу N частиц макросистемы). |
||
|
Последнее изменение этой страницы: 2018-05-30; просмотров: 510. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
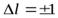
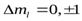
 . Функции, изменяющие знак при перестановке аргументов, называются антисимметричными:
. Функции, изменяющие знак при перестановке аргументов, называются антисимметричными:  .
.
 ,
, фазовых ячеек в интервале энергий
фазовых ячеек в интервале энергий 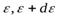 и среднее число частиц в каждой ячейке, т.е. функцию заполнения f, мы можем найти число частиц dn в данном интервале энергий (в расчете на единицу объема газа):
и среднее число частиц в каждой ячейке, т.е. функцию заполнения f, мы можем найти число частиц dn в данном интервале энергий (в расчете на единицу объема газа):
 , определяющие средние числа частиц в одной фазовой ячейке с энергией
, определяющие средние числа частиц в одной фазовой ячейке с энергией  ,или функции заполнения ячеек:
,или функции заполнения ячеек:
