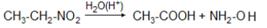Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
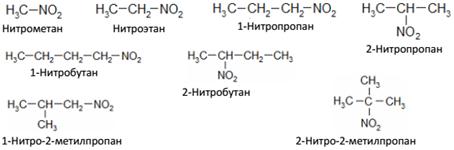
ГЛАВА 15. АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯИз органических соединений содержащих азот, рассмотрим нитросоединия, амины, нитрилы и изонитрилы. НИТРОСОЕДИНЕНИЯ Предельные нитросоединения имеют общую формулу Изомерия. Номенклатура Изомерия нитросоединений начинается, как и в случае монозамещенных углеводородов (спиртов, галогеналкилов и др.) с производных пропана. Различают первичные – R – CH2 – NO2, вторичные – R2 – CH – NO2 и третичные – R3 – C – NO2 нитросоединения. Нитросоединения называются по углеводороду с приставкой нитро-:
Способы получения По реакции Коновалова, нитрованием в газовой фазе:
Физические свойства Нитросоединения жирного ряда – жидкости, обладающие приятным запахом, перегоняющиеся без разложения; малорастворимы в воде, ядовиты, не корродируют металлы, их водные растворы имеют нейтральную реакцию. Плотности соединений с числом атомов углерода менее четырех – больше 1, с числом атомов четыре и более – меньше 1. Химические свойства 1. При восстановлении нитросоединений образуются первичные амины:
2. Первичные и вторичные нитросоединения растворимы в щелочах с образованием солей. Это объясняется тем, что водородные атомы при углероде, связанном непосредственно с нитрогруппой под влиянием последней, активируются, и в щелочной среде нитросоединения перегруппировываются в аци-нитро-форму (кислотную):
Таким образом, нитросоединения следует рассматривать как таутомерные вещества, реагирующие в нитро- и аци-нитроформах. Таутомерия (от греч. tautos – тот же и meras – мера) – явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга. Устанавливается равновесие.  Если щелочные растворы нитросоединений обработать минеральной кислотой, то происходит медленный обратный сдвиг равновесия:
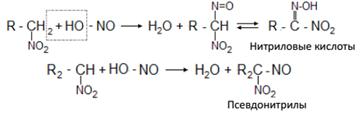
Поэтому нитросоединения относят к псевдокислотам.Для псевдокислот характерно, что сами они нейтральны, не обладают электропроводностью, тем не менее образуют нейтральные соли щелочных металлов. «Нейтрализация» нитросоединений основаниями (образование нейтральных солей) происходит медленно, а истинных кислот – мгновенно. 3. Активность водородных атомов у углерода, непосредственно связанного с нитрогруппой, проявляется и в ряде других реакций. Первичные и вторичные нитросоединения реагируют с азотистой кислотой, а третичные – не реагируют:
Щелочные соли нитриловых кислот в растворе имеют красный цвет. Псевдонитрилы в растворах и в расплавах окрашены в синий цвет. 4. Первичные и вторичные нитросоединения конденсируются в присутствии щелочей с альдегидами, образуя нитроспирты:
5. Аци-формы первичных и вторичных нитросоединений в водных растворах при действии минеральных кислот образуют альдегиды или кетоны:
6. Первичные нитросоединения при нагревании с 85%-ной серной кислотой переходят в карбоновые кислоты с отщеплением гидроксиламина. Реакция может служить промышленным методом получения гидроксиламина:
Отдельные представители В промышленном масштабе производятся первые представители гомологического ряда с числом углеродных атомов С1 – С8. Эти нитросоединения применяются как растворители, для получения нитроспиртов, нитроолефинов. Промышленное значение имеет производство гидроксиламина из нитроэтана при действии H2SO4:
Одновременно получается уксусная кислота. Все нитросоединения – сильные яды для ЦНС. Некоторые из них обладают раздражающим действием. Таков, например, трихлорнитрометан CCl3NO2 – хлорпикрин. В первой мировой войне использовался как боевое отравляющее вещество (ОВ). |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 251. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
 или
или  .
.