Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Физические и химические свойстваВсе дикарбоновые кислоты представляют собой твердые кристаллические вещества, растворимые в воде. Двухосновные карбоновые кислоты более сильные, чем одноосновные с тем же числом атомов углерода. Кислотность двухосновных кислот тем выше, чем короче цепь атомов углерода, связывающих карбоксильные группы. В соответствии с этим щавелевая кислота – самая сильная из двухосновных кислот. Двухосновные кислоты вступают в те же реакции, которые свойственны и одноосновным кислотам. Обладая двумя карбоксильными группами, двухосновные кислоты дают два ряда производных, в образовании которых участвуют один карбоксил
Кроме того существуют реакции характерные только для двухосновных кислот. 1. Разложение с выделением из одного карбоксила СО2 и превращением в одноосновную кислоту. Для такого разложения достаточно нагревания выше t плавления.
2. Образование из дикарбоновых кислот их циклических производных. При нагревании янтарной кислоты происходит выделение одной молекулы воды и образование ангидрида янтарной кислоты, имеющего строение пятичленного кольца (цикла):
При нагревании следующего гомолога янтарной кислоты – глутаровой кислоты – также образуется ангидрид циклического строения, кольцо ангидрида глутаровой кислоты имеет шесть атомов:
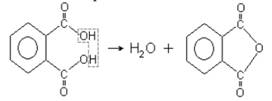
Аналогично двухосновная ароматическая фталевая кислота очень легко теряет воду и превращается в ангидрид фталевой кислоты или фталевый ангидрид:
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 253. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |