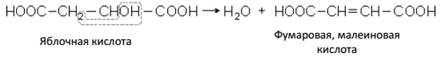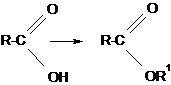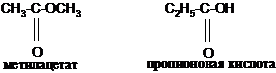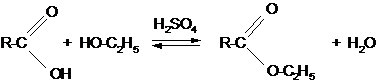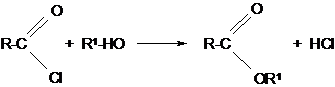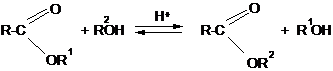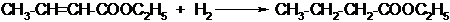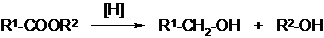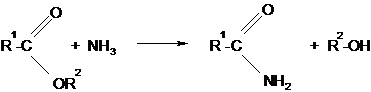Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
ДВУХОСНОВНЫЕ НЕПРЕДЕЛЬНЫЕ КИСЛОТЫНаиболее простые ненасыщенные двухосновные кислоты – фумаровая и малеиновая имеют одну и ту же структурную формулу, но разную пространственную конфигурацию. Фумаровая (I) – транс-, а малеиновая (II) – цис-изомер:
Обе кислоты получаются при нагревании яблочной кислоты:
Используются в производстве смол и присадок к моторным топливам.
СЛОЖНЫЕ ЭФИРЫ КАРБОНОВЫХ КИСЛОТ СЛОЖНЫЕ ЭФИРЫ– продукты замещения гидроксила кислоты на спиртовый остаток
Номенклатура Название сложных эфиров строится от названия углеводородного радикала и названия кислоты, в котором вместо окончания ²-овая кислота² используют суффикс ²-ат²
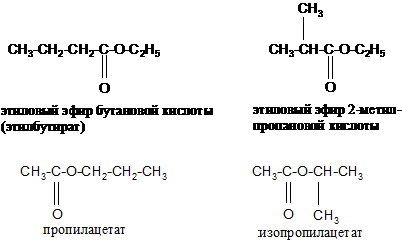
Изомерия Для сложных эфиров характерны три вида изомерии: 1. Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку – с пропилового спирта:
2. Изомерия положения сложноэфирной группировки:
3. Межклассовая изомерия
Получение 1. Взаимодействием спиртов с органическими кислотами
2. Из хлористых ацилов и спиртов
3. Из ангидридов кислот и спиртов
4. Реакцией переэтерификации
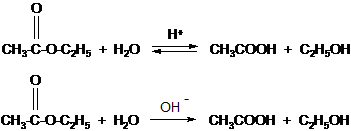
Химические свойства 1. Реакция гидролиза или омыления. Реакция этерификации является обратимой, поэтому в присутствии минеральных кислот будет протекать обратный процесс – гидролиз эфира с образованием исходных кислоты и спирта. Если проводить гидролиз эфиров в щелочном растворе, то реакция будет необратима
2. Реакция присоединения. Сложные эфиры, имеющие в своём составе непредельную кислоту или спирт, способны к реакциям присоединения. Например, при каталитическом гидрировании они присоединяют водород: 
3. Реакция восстановления. В результате образуются два спирта:
4. Образование амидов
Из эфиров азотной кислоты практическое значение имеют тринитрат глицерина (нитроглицерин) и амилнитрат:
Многие эфиры фосфорной кислоты обладают высокой физиологической активностью, например, производные диметилфосфата используются как инсектициды. ЖИРЫиМАСЛА – это сложные природные эфиры, которые образованы трёхатомным спиртом – глицерином и высшими жирными кислотами. Жиры входят в состав растительных и животных организмов и играют важную биологическую роль – служат одним из источников энергии. Жиры можно получить реакцией этерификации.
Жиры делят на ²простые² и ²смешанные². В состав ²простых² жиров входят остатки одинаковых кислот. В состав ²смешанных² жиров остатки различных кислот. В жирах наиболее часто встречаются следующие жирные кислоты. Алкановые (насыщенные) кислоты:
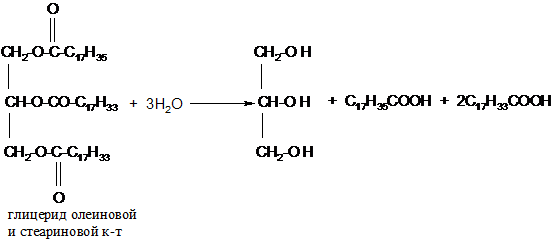
Алкеновая (ненасыщенная) кислота Олеиновая кислота С17Н33–СООН Алкадиеновая кислота Линолевая кислота С17Н31–СООН Алкатриеновая кислота Линоленовая кислота С17Н29–СООН Физические свойства По агрегатному состоянию жиры подразделяются на жидкие и твёрдые (при комнатной температуре). Твёрдые жиры, как правило, образованы предельными кислотами. Жидкие жиры (их часто называют маслами) образованы непредельными кислотами. Жиры растворимы в органических растворителях и нерастворимы в воде. Химические свойства 1. Гидролиз или омыление жиров происходит под действием воды (обратимо) или под действием щелочей (необратимо): а) кислотный гидролиз жиров
б) щелочной гидролиз жиров (омыление)
2. Гидрогенизация жиров – процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жиров. При этом остатки непредельных кислот переходят в остатки предельных кислот, и жидкие жиры превращаются в твёрдые (эту реакцию проводят на маргариновых заводах)
3. Жидкие жиры, взаимодействуя с кислородом воздуха, способны образовывать твёрдые плёнки – сшитые полимеры
4. При длительном хранении под действием влаги, кислорода воздуха, света и тепла жиры приобретают неприятный запах и вкус. Этот процесс называется ²прогорканием². Неприятный запах и вкус обусловлены появлением в жирах продуктов их превращения – свободных жирных кислот, гидроксикислот, альдегидов и кетонов. Мыла Мылами называются соли высокомолекулярных органических кислот. Обыкновенные мыла состоят, в основном, из смеси натриевых солей пальмитиновой (C15H31COOH), стеариновой (C17H35COOH) и олеиновой (C17H33COOH). Калийное мыло имеет вид мази и носит название жидкого мыла. Обычное мыло получают с помощью реакции “омыления” жиров. В жёсткой воде (содержащей ионы кальция и магния) моющая способность мыла уменьшается. Взаимодействуя с ионами кальция и магния, мыла образуют нерастворимые кальциевые и (или) магниевые соли 2C17H35COO- + 2Na+ + Ca2+ + 2HCO3- → (C17H35COO)2Ca +2Na+ + 2HCO3- В результате этого мыло образует вместо пены плёнку на поверхности воды и расходуется бесполезно. |
||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 278. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |