
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Теория активных столкновенийТеория активных столкновений ТАС основана на том, что химическое взаимодействие осуществляется только при столкновении активных частиц, которые обладают достаточной энергией для преодоления потенциального барьера реакции и ориентированы в пространстве друг относительно друга. Чтобы произошла реакция, частицы в момент столкновения должны обладать некоторым минимальным избытком энергии активации. При подсчете числа столкновений нужно учитывать эффективный диаметр молекул s. Согласно молекулярно-кинетической теории газов полное число столкновений за 1 с в 1 м3 между двумя разными молекулами
где N – число молекул газа в 1 м3, m – масса молекулы газа, кг. Если молекулы одинаковые, то общее число столкновений:
Активными будут столкновения, в которых суммарная энергия поступательного движения по линии, соединяющей центры сталкивающихся молекул, больше или равна энергии активации:
Число молекул, энергия которых будет больше или равна заданного значения энергии Е определяется уравнение распределения Больцмана:
Число активных столкновений рассчитывается на основании распределения Больцмана-Максвелла:
С другой стороны число активных столкновений определяет скорость процесса:
Отсюда уравнение константы скорости при столкновении неодинаковых молекул:
Полученное уравнение можно считать теоретическим обоснованием уравнения Аррениуса. Энергия активации в теории активных столкновений не вычисляется, а определяется из экспериментальной зависимости скорости реакции от температуры Предэкспоненциальный множитель в уравнении Аррениуса в рамках теории активных соударений: 
равен числу столкновений в 1 см3 за 1 с при единичной концентрации реагирующих веществ (1 моль/см3). Для бимолекулярных реакций постоянная Аррениуса имеет порядок 1014 ‒ 1015 см3/(моль·с). Величина А мало зависит от температуры. Множитель Несовпадение экспериментальных и теоретических значений констант скорости обычно объясняют тем, что часть столкновений молекул, имеющих необходимую энергию активации, не приводит к успеху в виду столкновений молекул с неактивными частицами. Доля столкновений, приводящая к конечному результату, учитывается так называемым стерическим фактором Р:
При неблагоприятной ориентации молекул по отношению друг к другу P < 1, при благоприятной Р = 1. Стерический фактор в большинстве случаев характеризует вероятность определенной геометрической конфигурации частиц при столкновении. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 569. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
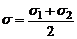
 ,
,





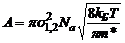 ,
, 
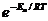 определяет долю активных столкновений.
определяет долю активных столкновений.