
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Кинетические уравнения каталитических реакцийДля примера рассмотрим каталитическую реакцию, протекающую по слитному механизму. Условия: система закрытая, V = const, реакции элементарные мономолекулярные, реакция (1) – обратимая, реакция (2) – не обратимая; подходит уравнение 1-го порядка.
+ уравнение мат.баланса по катализатору:
После установления квазистационарного режима:
С учетом мат.баланса:
и уравнение скорости процесса:
Выводы: 1) скорость реакции пропорциональна общей концентрации (количеству) катализатора в системе; 2) зависимость скорости реакции от концентрации реагента получается сложной. 3) при низкой концентрации реагента уравнение скорости процесса можно упростить:
kэф – эффективная константа скорости процесса Получается уравнение реакции первого порядка. 4) при высоких концентрациях реагента скорость реакции достигает максимального значения и не зависит от количества реагента:
т.е. порядок по реагенту равен нулю. Вывод: порядок каталитической реакции зависит от концентрации реагента и может меняться от нулевого до первого 5) при
и получается уравнение
которое широко используется для описания кинетики гомогенных и гетерогенных каталитических реакций. По линейной форме этого уравнения:
можно определить константы реакции, включая константу равновесия, если известна концентрация катализатора. Однако выяснение механизма сложных каталитических реакций и вывод их кинетических уравнений является трудоемким процессом. На практике ограничиваются исследованием кинетики реакций в узком температурном и концентрационном интервале. Получаемые кинетические уравнения носят формальный характер, а получаемые значения констант реакций представляют комплекс констант элементарных процессов.  |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 446. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |









 ,
, ,
, на первой стадии процесса устанавливается равновесие, а вторая будет лимитирующей, тогда:
на первой стадии процесса устанавливается равновесие, а вторая будет лимитирующей, тогда: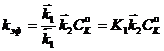
 ,
,