
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
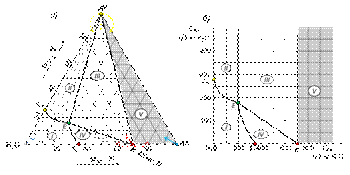
Диаграмма растворимости двух солей с одноименным ионом и образованием кристаллогидрата одной из солейРассмотрим случай, в котором кристаллизация соли АХ сопровождается связыванием определенного количества кристаллизационной воды с образованием кристаллогидрата состава АХ·nН2О. На треугольной диаграмме растворимости солей АХ и AY составу такого кристаллогидрата отвечает точка K, лежащая на стороне треугольника между вершинами АХ и Н2О.
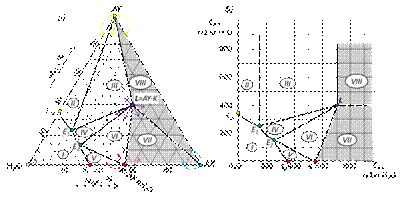
Рис. 36. Диаграммы растворимости двух солей с одноименным ионом и образованием кристаллогидрата одной из солей в треугольнике Гиббса (а) и прямоугольных координатах (б). Поскольку при кристаллизации 1 моль соли АХ связывается в кристаллогидрат п молей воды, равновесное сосуществование трех фаз: раствора, кристаллов АХ·nН2О и кристаллов AY, возможно лишь при составах, включающих необходимый минимум воды, не участвующей в образовании кристаллогидрата. Эти составы отвечают незаштрихованной части треугольника, расположенной слева от соединительной линии между точками AY и K. Заштрихованная часть диаграммы (область V) отвечает трем твердым фазам: кристаллам АХ, AY и АХ·nН2О. Точка K отвечает такому содержанию соли АХ на 1000 г воды, когда вся вода израсходована на образование кристаллогидрата. Поле I отвечает ненасыщенным растворам солей АХ и AY, а линии, ограничивающие эту область, - насыщенным растворам этих солей. Поле II представлено двумя фазами: кристаллами AY и равновесными с ними насыщенными растворами состава SAY-E, а поле IV соответствует насыщенным растворам состава SK-E и равновесным с ними кристаллам АХ nН2О. В поле III в равновесии с насыщенным раствором состава Е находятся кристаллы АХ·nН2О и AY. Диаграмма растворимости двух солей с одноименным ионом и образованием кристаллогидрата двойной соли  Если в виде кристаллогидрата выделяется химическое соединение, то составу кристаллогидрата отвечает точка (L), лежащая внутри треугольника.
Рис. 37. Диаграмма растворимости двух солей с одноименным ионом, с образованием кристаллогидрата одной из солей и кристаллогидрата двойной соли в треугольнике Гиббса (а) и прямоугольных координатах (б). Поля диаграммы VII и VIII отвечают полностью закристаллизовавшимся системам: в поле VII в находятся 3 кристаллические фазы: AX, K и L; в поле VIII – AX, L и AY. Сторонам треугольников VII и VIII соответствуют двухфазные кристаллические системы. Например, на сторонах треугольника VII расположены двухфазные системы AX + L (граница с полем VIII), AX + K (основание треугольника) и K + L (граница с полем VI). Двухфазные системы, содержащие жидкую фазу, расположены в поле II (кристаллы AY и раствор состава SAY-E1, насыщенный относительно AY), поле IV (кристаллы L и раствор состава E1-E2, насыщенный относительно кристаллогидрата двойной соли L) и в поле V (кристаллы вещества K – кристаллогидрата соли AX и раствор состава E2-K, насыщенный относительно K). Трехфазные системы с присутствием жидкой фазы находятся в поле III (кристаллы AY, кристаллы L и раствор состава E1, насыщенный по обоим веществам) и поле VI (кристаллы K и L и раствор состава Е2, насыщенных по обоим кристаллогидратам). Скорость химических реакций. Электрохимия Химическая кинетика Формальная кинетика Скоростью химической реакции называется скорость изменения количества участвующих в ней веществ в единицу времени. Величина скорости реакции имеет знак «+» для продуктов реакции и «–» для исходных веществ. Для гипотетической реакции aA + bB = eE
или в общем случае
Для реакций, протекающих в объеме V:
Для гетерогенных реакций, протекающих на поверхности S:
Таким образом, по скорости изменения концентрации только одного из реагирующих веществ можно определить скорость изменения концентрации остальных реагентов. Элементарная стадия процесса – наиболее простая составная часть реакции. Состоит из отдельных актов химического превращения. Все элементарные стадии являются обратимыми, могут протекать параллельно и последовательно. В ходе элементарных стадий образуются как промежуточные вещества, так и продукты реакции. Элементарные стадии реакции проходят через образование промежуточного или активированного комплекса. Активированный комплекс – такое состояние системы, в котором еще сохраняются старые химические связи и одновременно идет образование новых связей. Это уже не исходное вещество, но еще и не продукт реакции. Образованию активированного комплекса соответствует энергетически насыщенное состояние системы (энергетический максимум). Такое состояние термодинамически не устойчиво. В элементарной стадии процесса может участвовать одна или несколько частиц. Число частиц, участвующих в элементарной стадии реакции называется молекулярностью реакции. Если в элементарной стадии участвует 1 частица – мономолекулярная реакция; 2 частицы – бимолекулярная реакция; 3 частицы – тримолекулярная реакция (вероятность такого события крайне мала). Молекулярность реакции можно оценить по значениям стехиометрических коэффициентов, если конечно известно уравнение реакции. Для примера представим, что следующие процессы являются элементарными реакциями:
Совокупность элементарных стадий является механизмом реакции. Если точный механизм установить невозможно, то говорят о наиболее вероятном механизме процесса. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 481. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
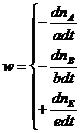
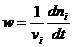
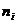 – количество вещества компонента реакции; t – время протекания процесса,
– количество вещества компонента реакции; t – время протекания процесса, 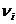 – стехиометрический коэффициент; для исходных веществ
– стехиометрический коэффициент; для исходных веществ 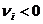 , для продуктов реакции -
, для продуктов реакции - 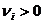 .
.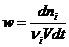 , моль∙л−1∙с−1,
, моль∙л−1∙с−1,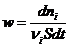 , моль∙м−2∙с−1
, моль∙м−2∙с−1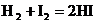 , тогда молекулярность реакции – 2.
, тогда молекулярность реакции – 2.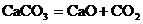 молекулярность реакции – 1.
молекулярность реакции – 1.