
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Кинетика гетерогенных процессовГетерогенные процессы протекают на границе двух фаз. Примеры: кристаллизация, испарение, конденсация, химические гетерогенные процессы, электрохимические процессы на границе электрод – раствор электролита и т.п. Гетерогенный процесс состоит из следующих основных стадий: доставка реагента к поверхности, химическая реакция, отвод продуктов реакции от реакционной поверхности. Каждая из перечисленных стадий может являться лимитирующей. Если лимитирующей стадией является химическая реакция, то это вопрос формальной кинетики и описывается уравнениями формальной кинетики. Доставка вещества к реакционной поверхности чаще всего определяется скоростью диффузии. Диффузия – перемещение молекул вещества в неподвижной среде под влиянием градиента концентрации. Скорость диффузии – количество вещества, проходящее через данное поперечное сечение в единицу времени. Количественные закономерности диффузии описываются уравнениями Фика. Первое уравнение Фика:
Скорость диффузии
Величина коэффициента диффузии зависит от вязкости среды. При увеличении температуры вязкость увеличивается согласно уравнению:
следовательно, коэффициент диффузии тоже увеличивается. Взаимосвязь коэффициента диффузии и вязкости описывается уравнением Стокса-Эйнштейна:
Второе уравнение Фика описывает диффузию в пространстве Для одномерного пространства: 
Для трехмерного пространства:
Уравнение скорости гетерогенного процесса, лимитируемого процессом диффузии, получают при интегрировании второго уравнения Фика при конкретных начальных и граничных условиях. Если раствор перемещается относительно реакционной поверхности, то перенос вещества идет двумя путями: за счет перемешивания (конвекции) и за счет диффузии, т.е. за счет конвективной диффузии. 1. Вблизи поверхности твердого тела даже при наличии конвекции имеется неподвижный слой жидкости – эффективный диффузионный слой δ. 2. Толщина диффузионного слоя составляет несколько тысяч размеров молекулы (0,01 – 0,1 мм). 3. Внутри диффузионного слоя конвекция отсутствует. 4. Концентрация вещества в эффективном диффузионном слое на границе с раствором равна концентрации в объеме раствора C0 5. Концентрация вещества в эффективном диффузионном слое от границы с раствором к поверхности твердого тела падает (рис. 17). 6. Концентрация вещества в диффузионном слое у поверхности раздела фаз имеет некоторое постоянное значение Сs.
Рис. 39. Схема изменения концентрации вещества в диффузионном слое 7. Эффективная толщина диффузионного слоя [не имеет физического смысла и] представляет собой эмпирический коэффициент. 8. Внутри диффузионного слоя доставка вещества к реакционной поверхности только за счет диффузии. Условие стационарной линейной диффузии: При стационарной линейной диффузии второй закон Фика:
концентрация реагирующего на поверхности вещества меняется внутри диффузионного слоя линейно с расстоянием от поверхности твердого тела. Скорость гетерогенной реакции, лимитируемой процессом стационарной линейной диффузии, будет тогда описываться таким дифференциальным уравнением:
β – коэффициент массопередачи, D – коэффициент диффузии, s – поверхность, на которой протекает гетерогенная реакция. Если сама химическая реакция протекает достаточно быстро, то Cs = 0 и уравнение скорости реакции:
уравнение реакции первого порядка!!! Скорость стационарного гетерогенного процесса, лимитируемого диффузией подчиняется уравнению реакций первого порядка
где m0 – количество вещества в растворе в начальный момент времени, mt количество вещества в растворе в текущий момент времени, t – продолжительность протекания процесса; V – объем раствора, s – площадь реакционной поверхности. Количество вещества, прореагировавшее за время t:
При повышении температуры лимитирующая стадия и соответственно механизм гетерогенного процесса могут меняться. Это связано с разным характером зависимости константы скорости реакции и коэффициента массопереноса от температуры.
(ν – показатель степени, с которым коэффициент диффузии и константа скорости входят в соответствующие уравнения скорости процесса)
Рис. 40. Влияние температуры на константу скорости гетерогенного процесса. AB – кинетическая область, CD – диффузионная область, DC – промежуточная область. При повышении температуры константа скорости химического процесса быстро увеличивается и, начиная с некоторой температуры, k > β, - константа скорости процесса больше коэффициента массопередачи и лимитирующей стадией становится диффузия. Переход из кинетической области в диффузионную происходит постепенно. При этом наблюдается изменение углового коэффициента на графике зависимости константы скорости от температуры. По величине углового коэффициента (т.е. по энергии активации) и судят о природе лимитирующей стадии. Если энергия активации 5 – 20 кДж/моль, то процесс диффузионный. Если энергия активации 50 – 200 кДж/моль, то процесс кинетический. Катализ |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 730. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |

 пропорциональна площади поперечного сечения s и градиенту концентрации
пропорциональна площади поперечного сечения s и градиенту концентрации  . Коэффициент пропорциональности D – коэффициент диффузии, м2∙с−1 – скорость диффузии через единичное сечение (1 м2) при единичном градиенте концентрации (1 моль/м4)
. Коэффициент пропорциональности D – коэффициент диффузии, м2∙с−1 – скорость диффузии через единичное сечение (1 м2) при единичном градиенте концентрации (1 моль/м4)
 ,
,




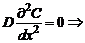



 ,
, 
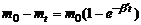
 и
и 
 и
и 
