
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
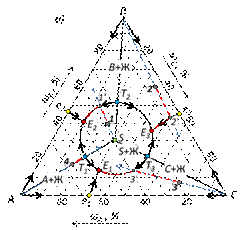
Диаграмма состояния трехкомпонентной конденсированной системы с одним тройным химическим соединением, плавящимся без разложенияКомпоненты системы образуют одно тройное химическое соединение S с конгруэнтной точкой плавления. Характерным признаком такого соединения является расположение химического соединения в своем поле.
Рис. 33. Трехкомпонентная система с одним тройным соединением, плавящимся без разложения. Соединительные линии AS, BS и CS проходят через поле химического соединения и делят эту диаграмму на три треугольника Алькемаде: ASC, ASB и BSC. Каждый из них представляет простейшую подсистему с одной точкой тройной эвтектики: E1, E2 и Е3. По правилу Алькемаде, в точках Т1, Т2 и Т3 температуры на граничных линиях максимальны и уменьшаются в обе стороны от этих точек. Эти точки можно рассматривать как точки двойных эвтектик треугольников Алькемаде. Трехкомпонентные водно-солевые системы Краткие теоретические сведения Частным случаем трехкомпонентных систем являются водные растворы двух солей с одноименными ионами. Если у двух растворенных солей нет такого иона, то система является уже не трех-, а четырехкомпонентной, так как в нее входят пять индивидуальных веществ: вода и четыре соли, участвующие в обменной реакции, приводящей к равновесию:
В этом случае число компонентов системы, равное разности между числом индивидуальных веществ системы и числом уравнений, 5 – 1 = 4. Две соли с общим ионом не реагируют между собой, и система из двух солей и воды является трехкомпонентной. При изучении последовательности кристаллизации этих солей при изотермическом испарении растворителя из раствора можно также использовать треугольные диаграммы состояния или диаграммы Шрайнемакерса в прямоугольной системе координат.  В последнем случае начало координат соответствует чистому растворителю. По осям откладываются в заданном масштабе концентрации каждой из солей, выраженные любым способом (грамм на 100 г воды, моль на 100 моль воды и др.), а также точки, соответствующие растворимости данной соли при данной температуре. Затем при построении диаграммы изучают изменение растворимости каждой из солей при совместном их присутствии в растворе в различных количествах. Полученные данные наносят на диаграмму. Располагая такой диаграммой, можно определить состав ненасыщенных растворов, состав кристаллов, образующихся из сложного раствора данного состава, изменение состава раствора по мере кристаллизации солей, влияние температуры на последовательность кристаллизации и состав твердых фаз, а также зафиксировать образование в системе двойных солей или кристаллогидратов. Порядок рассмотрения диаграммы состояния трехкомпонентной водно-солевой системы 1. Перечертить диаграмму, соблюдая топологию, в заданном масштабе. 2. Дать общую характеристику диаграммы. 3. Обозначить поля диаграммы греческими или римскими цифрами. 4. Обозначить все значимые точки диаграммы: точки растворимости компонентов системы, эвтонические точки, точки образования кристаллогидратов и др. 5. Указать фазовый состав полей диаграммы. 7. Указать процессы, протекающие на граничных линиях и в значимых точках диаграммы. 10. Показать пути кристаллизации для заданных фигуративных точек диаграммы. 11. Рассмотреть свойства систем, заданных соответствующими фигуративными точками Характеристика отдельных фигуративных точек диаграммы
Типовые диаграммы состояния |
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 420. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
|||||||||||||||||||||||||
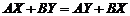 .
.