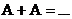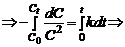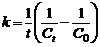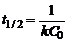Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Порядок реакции и способы его определенияПонятие порядка реакции Приближение элементарной реакции:
Скорость реакции пропорциональна произведению концентраций реагентов в степени, равной абсолютному значению их стехиометрических коэффициентов. В современном представлении
где k – константа скорости реакции; ее физический смысл – скорость реагирующих веществ при их единичной концентрации; показывает зависимость скорости реакции от температуры; при данной температуре при данной реакции k = const; n – порядок реакции по каждому реагенту. Различают порядок реакции по данному реагенту и суммарный порядок реакции. Суммарный порядок реакции: Для элементарной реакции величина порядка реакции совпадает с молекулярностью. Для сложного процесса величина порядка реакции устанавливается на основании экспериментальных данных. Может оказаться дробной величиной. По величине порядка реакции различают процессы нулевого, первого, второго порядков (эти ситуации встречаются довольно часто), а также третьего и четвертого порядков (очень редко). Метод подстановки Этот метод заключается в подстановке экспериментальных данных в соответствующее кинетическое уравнение. В ходе реакции должно сохраняться (в пределах допустимых ошибок) постоянство константы для любых двух экспериментальных точек. Если постоянство константы не наблюдается при использовании любых из указанных выше уравнений, то реакция имеет более сложное кинетическое уравнение. Графический метод Порядок реакции можно установить, если графически определить, какая функция от концентрации линейно зависит от времени с наименьшим среднеарифметическим отклонением.  При большом разбросе точек на всех графиках Уравнения формальной кинетики Односторонняя реакция первого порядка Уравнение реакции: Кинетическое уравнение:
Из уравнения следует, что константа скорости реакции первого порядка имеет размерность Для характеристики скорости реакции первого порядка (и других порядков тоже) наряду с константой скорости часто пользуются временем полупревращения (полураспада) – промежутком времени, в течение которого реагирует половина взятого количества вещества (
Время полупревращения для реакций первого порядка не зависит от количества или концентрации исходного вещества и обратно пропорционально константе скорости реакции. Односторонние реакции второго порядка Ситуация одного вещества или разных веществ одинаковой концентрации Уравнение реакции: Кинетическое уравнение:
Отсюда следует, что реакции второго порядка должны соблюдать прямолинейность в координатах 1/С ‒ t. При этом время полупревращения зависит от начальной концентрации:
|
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 409. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |


 ,
, .
. ,
,  и
и  предпочтение отдается тому их них, где во-первых, наблюдается равномерный разброс точек по обе стороны от прямой, а, во-вторых, дисперсия R2 минимальна.
предпочтение отдается тому их них, где во-первых, наблюдается равномерный разброс точек по обе стороны от прямой, а, во-вторых, дисперсия R2 минимальна.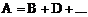


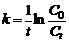 и
и 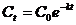
 .
.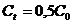 ). Для реакции первого порядка:
). Для реакции первого порядка: