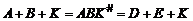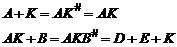Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Общие представления о катализеКатализ – явление ускорения реакций в присутствии веществ – катализаторов, которые вступают в промежуточное взаимодействие с реагирующими веществами, но не входят в состав продуктов реакции. Под промежуточным взаимодействием понимают: = образование реакционноспособного вещества с катализатором, = участие последнего в образовании активированного комплекса хотя бы в одной из стадий протекания процесса. Катализатор не входит в состав веществ и продуктов реакции. Следовательно, он не может оказывать влияние на изменение энергии Гиббса реакции. Следовательно, катализатор не влияет на положение химического равновесия, а только изменяет (увеличивает) скорость процесса. В состоянии равновесия катализатор одинаково ускоряет как прямую, так и боратную реакции. Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор и реагирующие вещества образуют единую фазу, чаще всего жидкую, в которой протекает каталитическая реакция. К гомогенным катализаторам относят также ферменты и энзимы – биокатализаторы, под действием которых в живых организмах протекает синтез большинства веществ, необходимых для жизнедеятельности. Гетерогенно-каталитические реакции протекают на границе раздела фаз, образуемых катализатором и реагентами. Наиболее часто в качестве гетерогенных катализаторов используют твердые тела, при этом реагирующие вещества находятся в жидкой или газовой фазе. Промежуточное химическое взаимодействие реагентов с катализатором может протекать слитно и раздельно. При слитном каталитическом процессе в состав активированного комплекса входят наряду с катализатором все реагирующие вещества: 
Увеличение скорости достигается в результате уменьшения энергии активации при химическом взаимодействии реагентов с катализатором. По слитному механизму протекают реакции гомогенного и ферментативного катализа. Температура 300–400 K. При раздельном механизме каталитический процесс осуществляется поэтапно, в несколько стадий. Энергетический рельеф имеет несколько максимумов (активированные комплексы отдельных стадий) и минимумов (продукты промежуточного взаимодействия)
Разделение реакции на несколько стадий уменьшает число и суммарную энергию разрыва старых связей. Однако при этом суммарная энергия активации реакции может и не уменьшиться. Реакции с раздельным механизмом катализа происходят при гетеролитическом разрыве связи. Температура – 600–800 K. Обе схемы отражают общую и характерную особенность механизма каталитических реакций – цикличность. Любая каталитическая реакция состоит как минимум из двух стадий: 1) взаимодействие активного центра с молекулой реагента и образование промежуточного соединения; 2) распад промежуточного соединения с образованием продукта реакции и свободного активного центра. Обе стадии вместе представляют собой каталитический цикл. Число циклов, совершающихся за единицу времени на одном активном центре, называют числом оборотов катализатора. |
||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 456. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |