
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Краткие теоретические сведенияПарциальные давления компонентов рА и рВ обоих компонентов в паровой фазе определяются 1) законом Рауля (в приближении идеального газа)
хА и хВ – мольная доля компонента А и В в жидкой фазе. 2) законом Дальтона:
Состав газовой фазы определяется уравнением:
Поскольку в бинарной системе хВ = 1 – хА, отношение парциальных давлений в паровой фазе определяется уравнением
Парциальное давление компонента в газовой фазе pi кроме того связано с общим давлением пара РΣ через мольные доли обоих компонентов в паровой фазе уi:
Тогда
Последнее уравнение представляет зависимость между относительными концентрациями легкокипящего компонента в парах и в жидкости. Пар и жидкость различны по составу только тогда, когда α > 1. И лишь в этом случае возможно разделение компонентов при перегонке. Обогащение паров легко летучим компонентом чем больше, чем больше α, т.е. чем больше различаются давления насыщенных паров чистых компонентов. В соответствии с первым законом Коновалова, состав жидкости и газа в состоянии равновесия различен, причем газ, по сравнению с жидкостью, богаче тем компонентом, добавление которого повышает общее давление пара над раствором, т.е. понижает температуру кипения раствора. Неконденсированные системы изучают с помощью как изобарических сечений диаграмм их состояния (в координатах температура и состав), так и изотермических сечений в координатах давление - состав. В уравнении, определяющем число степеней свободы системы по правилу фаз Гиббса, число внешних переменных уменьшается до единицы 
Максимальное число фаз, находящихся в равновесии в таких системах, не превышает трех, системы с двумя фазами имеют одну степень свободы, а с одной - две степени свободы. Каждая точка внутри диаграммы характеризует свойства системы при заданном сочетании температуры, давления и исходного состава. Любая вертикальная прямая на проекции диаграммы – это линия постоянного состава. Наклонные линии показывают зависимость температуры определенного фазового перехода от исходного состава системы и состава равновесных фаз от температуры. Порядок рассмотрения диаграммы 1. Перечертить диаграмму, соблюдая топологию, в заданном масштабе. 2. Дать общую характеристику диаграммы. 3. Отметить линию газа, линию жидкости, линии растворимости компонентов; написать равновесия на линиях. 4. Обозначить поля диаграммы греческими или римскими цифрами. 5. Указать фазовый состав полей диаграммы. 6. Описать значимые точки диаграммы (точки кипения компонентов, точки азеотропа, точки Алексеева): указать температуру, состав, уравнение равновесия. 7. Рассмотреть свойства систем, заданных соответствующими фигуративными точками и заполнить таблицу
Типовые диаграммы состояния Диаграммы состояния неконденсированных систем с неограниченной растворимостью в жидком состоянии
Рис. 10. Проекции изобарического (а) и изотермического (б) сечений диаграммы состояния неконденсированной двухкомпонентной системы. Общая характеристика диаграммы. На рисунке показана диаграмма с полной растворимостью компонентов в жидкой фазе. Точки азеотропа отсутствуют. Линии диаграммы.Верхнюю линию называют «линия газа». На линии газа устанавливается равновесие ж = г На этой линии начинается конденсация пара и заканчивается кипение жидкости. Линия газа или линия конденсации и показывает состав насыщенного пара, находящегося в равновесии с жидкостью. По линии газа определяют состав газовой фазы двухкомпонентной системы. Нижнюю линию называют «линия жидкости». На линии жидкости устанавливается равновесие ж = г На этой линии начинается кипение жидкости и заканчивается конденсация пара. По линии жидкости определяют состав жидкой фазы. Например, точке X отвечает общий состав 60 % компонента В и 40 % компонента А. Пар содержит около 25 % компонента В и 75 % более летучего компонента А. Поля диаграммы. Линии жидкости и газа делят диаграмму на три поля. Два из них отвечают условиям существования одной фазы, состоящей из двух компонентов: газа (Г) при низком давлении и высокой температуре или раствора жидких компонентов друг в друге при высоком давлении и низкой температуре (Ж). Система, представленная одной из этих фаз, имеет две степени свободы, т.е. одновременно может изменяться состав, а также температура или давление (точки 1 и 4). Третье поле диаграммы, расположенное между линиями, представляет две находящиеся в равновесии друг с другом фазы: жидкость и насыщенный пар, имеющие различный состав и лишь одну степень свободы. Поскольку такая система является моновариантной (F = 2 + 1 - 2 = 1), состав этих фаз зависит от температуры и давления и при постоянном значении этих параметров также строго постоянен. Точки диаграммы.Точки ТА и TВсоответствуют температурам кипения и конденсации чистых компонентов A и В при постоянном давлении. В этих точках в безвариантном равновесии находятся две фазы – жидкость и газ (F = 1 - 2 + 1 = 0), и поэтому температура и давление остаются постоянными до тех пор, пока не закончится испарение жидких компонентов или конденсация их паров. Точку X, а также точки W и C, называют сопряженными, т.к. расположены на одной горизонтальной прямой, носящей название нода. Длина ноды |WC|, а также отрезков ее, отсекаемых точкой X, позволяет рассчитать относительное количество находящихся в равновесии фаз по правилу рычага. Правило рычага Для нахождения относительных количеств фаз в системе служит правило рычага, согласно которому фигуративная точка, отвечающая общему составу гетерогенной системы (т. Х) делит ноду WC на отрезки WХ и ХC, длина которых обратно пропорциональна количествам равновесных фаз:
Относительное количество фаз, в долях от общего содержания, вычисляется по формулам:
В зависимости от единиц измерения состава системы, количества фаз g могут быть выражены в молях или в единицах массы; относительное количество фаз ω – в мольных или массовых долях соответственно. Характеристика отдельных фигуративных точек диаграммы
Диаграммы с азеотропом Во многих случаях наблюдаются весьма значительные отклонения свойств растворов реальных веществ от свойств идеальных растворов. Поэтому на диаграммах состояния на линиях газа и жидкости отмечают экстремальные точки: максимум или минимум.
Рис. 11 Экстремальные точки на кривых конденсации и испарения. Второй закон Коновалова гласит: «В экстремальных точках диаграммы составы жидкости и газа одинаковы, и этим точкам соответствует общая горизонтальная касательная».Жидкости, состав которых соответствует экстремумам на диаграммах, называются азеотропными или нераздельно кипящими. Различия в составе жидких фаз и паров широко используются при разделении веществ методом простой или фракционной перегонки (дистилляции). Если на диаграмме состояния нет экстремальных точек, то можно получить компоненты в чистом виде, в противном случае фракционная перегонка позволяет получить чистым лишь один из компонентов и азеотропную жидкость, содержащую оба компонента. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-04-12; просмотров: 426. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 или
или  и
и  для бинарной системы
для бинарной системы и
и  – давление насыщенного пара чистого компонента;
– давление насыщенного пара чистого компонента; для бинарной системы.
для бинарной системы.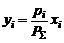
 .
. и
и  .
. .
. – относительная летучесть.
– относительная летучесть.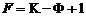 .
.
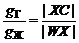 .
.

