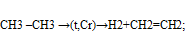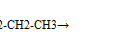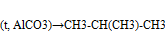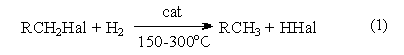Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Галогенопроизводные углеводородовСтр 1 из 18Следующая ⇒ Типы химических связей в органических соединениях Ковалентной связью называется внутримолекулярная химическая связь, осуществляемая за счет одной или нескольких электронных пар, сильно взаимодействующих с ядрами обоих соединяемых атомов. Сигма-связь – связь, образованная в результате перекрывания электронных облаков и расположенная на прямой, соединяющей центры ядер атомов. Пи – связь – связь, образованная в результате перекрывания электронных облаков и расположенная вне прямой, соединяющей центры ядер атомов.
Виды изомерии в органических соединениях Изомерия-явление сущ-ия Изомеров.Изомер-вещ-ва имеющие одинаковый сост-в атомов, но различное в строе ние. А)Структурная изомер-я 1)Изомерия углеродного скелета. Различая во взаимном расположении атомов С. 2)Изомерия по положению кратной связи (двойной). 3)Из положения функциональной группы Различия положения функциональной группы относительно углеродного скеле та. В)Пространственная изомер-я Связана с различным положе нием атомов или групп атомов относительно двойной связи.(цис-(ванна) и транс-изомеря(кресло), зеркальная изоиерия)
Предельные углеводороды, их химические свойства. СН4 - метан; С2Н6 - этан; С3Н8 - пропан С4Н10 - бутан (2 изомера) С5Н12 - пентан (3 изомера) С6Н14 - гексан , С7Н16 - гептан  С8Н18 - октан С9Н20 - нонан С10Н22 – декан Химические св-ва: 1)Замещение: CH4+Cl2→CH3Cl+HCl (хлористый метил) CH3Cl+HCl→CH2Cl2+HCl (хлористый метилен) CH2Cl2+Cl2→CHCl3+HCl (хлороформ) 3)Нитрование: характерно для имеющим вторичный или третичный атом углерода.
Р-я КОНОВАЛОВА 4)При температуре 100-500ºС и доступе кислорода образуются жирные кислоты, а при температуре 500-600ºС наблюдается крекинговый процесс - р-я горения CH4+2O2 →CO2+H20(полное), 2СН4+О2à2СО+4Н2(неполное) -Каталитическое окисление2СН3-СН2-СН2-СН3 + 5О2 →4СН3СООН (уксусная кислота), -реакция отщипления:
-изомеризация
Получение алканов. Получение метана в промышленности: 1. Фракционированием природного газа и перегонкой нефти. 2. Синтез из элементов при высокой температуре (вольтова дуга), C + 2H2 →CH4 Химические способы получения: 1)Из солей органических кислот. Cплавление ацета та натрия со щелочью: СН3СOONa + NaOH →CH4 + Na2CO3 2)Синтез Вюрца: CH3Cl+2Na+ClCH2-CH3→2NaCl+C3H8 3)Из магний органических соединений: CH3Br+Mg→CH3MgBr 4)СинтезБертло: C2H5I+HI→C2H6+I2 5)Из алкенов 6) Восстановление галогенпроизводных алканов.CH3Cl+H2→(p,pt)→CH4+HCl
Галогенопроизводные углеводородов Это производные предельных и непроедельных,аро Матических углеводородов, у ко торых 1 или несколько атомов Н замещены на галагены Галогенопроизводные углеводо родов получают непосредствен ным взаимодействием углево дородов (как предельных, так и непредельных) с галогенами. Галогенопроизводные углеводородов используются для синтеза многих органических веществ (спиртов, аминов и др.). Получение:1)Галагенирование СН4 + Cl2 →CHCl3 + HCl; CH3Cl + Cl2 →CH2Cl2 + HCl; CH2Cl2 + Cl2 →CHCl3 + HCl; CHCl3 + Cl2 →CCl4 + HCl
2)из непредельных углеводородов.(этен + хлор)
3)изспиртов3R-OH+PCl3→3R-Cl+H3PO4; CH3-OH+Br2→CH2Br-OH+HBr Химсв-ва:1)РеакцияВюрца+2Na+ClCH2-CH3→2NaCl+C3H8 ,
2) 3) 2RHal + Na →R–R + 2NaHa 4) а) реакциигидролиза RHal + H2O → ROH + HHal RHal + NaOH → ROH + NaHal б) реакции образования простых эфиров (реакция Вильямсона) RHal + R`ONa →ROR` + NaHal в) синтез сложных эфиров R1Hal + RCOONa → RCOOR1 + NaHal |
||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 217. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
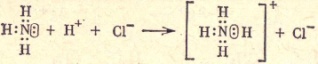 Алканы (парафины) - это насы щенные (предельные) углево дороды с открытой цепью. Они имеют общую формулу СnН2n+2, В алканах атомы углерода связаны между собой только простыми (одинарными) связями, а остальные валент ности углероданасыщены ато мами водорода. Характерный суффикс для насыщенных углеводородов-ан.,
Алканы (парафины) - это насы щенные (предельные) углево дороды с открытой цепью. Они имеют общую формулу СnН2n+2, В алканах атомы углерода связаны между собой только простыми (одинарными) связями, а остальные валент ности углероданасыщены ато мами водорода. Характерный суффикс для насыщенных углеводородов-ан.,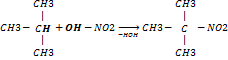
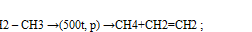 (крекинг)
(крекинг)