Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
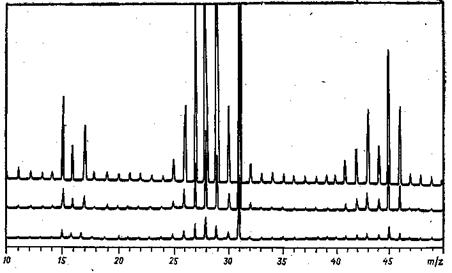
ПРИРОДА И ПОЛУЧЕНИЕ МАСС-СПЕКТРОВДанный метод принципиально отличается от рассмотренных выше спектроскопических методов, в основе которых лежит поглощение электромагнитных колебаний. Структурная масс-спектрометрия основана на разрушении органической молекулы под действием электронного удара и регистрации массы образующихся осколков. Допустим, что через пары вещества проходит, поток электронов, энергию которых можно постепенно увеличивать. Если эта энергия достигнет определенного уровня, то при столкновении электрона с молекулой может произойти отрыв («выбивание») из нее электрона с образованием молекулярного иона М+∙. ABCD + e- ® ABCD+ ∙ + 2e- молекула молекулярный ион Наименьшая энергия бомбардирующих (ионизующих) электронов, при которой возможно образование из данной молекулы иона, называется энергией (или, менее удачно, «потенциалом») ионизации вещества (Uе). Энергия ионизации является мерой прочности с какой молекула удерживает наименее сильно связанный с ней электрон, следовательно, чем прочнее связь электронов с молекулой вещества, тем выше энергия ионизации. Как правило, для органических молекул энергия ионизации составляет 9—12 эВ (для циклогексана 10 эВ, для бензола 9 эВ). Если энергия ионизующих электронов значительно превышает энергию ионизации, образующийся молекулярный ион получает избыточную энергию, которой может оказаться достаточно для разрыва в нем связей. В результате такого разрыва происходит распад молекулярного иона на частицы меньшей массы (фрагменты). Такой процесс называется фрагментацией. В практике масс-спектрометрии используются электроны с энергией 30— 100 эВ, что намного превышает энергию ионизации и обеспечивает фрагментацию молекулярного иона.  Реальная структура ионов, образующихся под электронным ударом, в подавляющем большинстве случаев не установлена. Для изображения строения фрагментов обычно используются стандартные структурные символы органической химии. Несмотря на условность такого изображения и, в основном, эмпирический характер закономерностей фрагментации, измерение массы образующихся осколков и их относительного количества позволяет получить ценную информацию о строении органических соединений. Для получения масс-спектра пары вещества небольшими количествами с помощью специальной системы напуска вводятся в ионизационную камеру, где поддерживается глубокий вакуум (остаточное давление около 10-6 мм рт. ст.). Молекулы вещества бомбардируются потоком электронов, излучаемых раскаленным катодом. Разность потенциалов между катодом и анодом ускоряет электроны до определенного уровня энергии (например, до 30± 2 эВ). Образующиеся ионы выталкиваются из ионизационной камеры небольшой разностью потенциалов. Получаемый поток ионов ускоряется, фокусируется сильным электрическим полем и попадает в магнитное поле. В результате бомбардировки молекул вещества электронами образуются частицы, имеющие положительный или отрицательный заряд, а также нейтральные частицы. При прохождении потока частиц через магнитное поле нейтральные частицы не изменяют направления, а положительные и отрицательные отклоняются в разные стороны. Величины отклонения ионов пропорциональны заряду и обратно пропорциональны их массе, иными словами, обратно пропорциональны массе, приходящейся на единицу заряда (m/z). В обычной масс-спектрометрии принято регистрировать только частицы, имеющие положительный заряд. Учитывая, что заряд частицы, как правило, равен единице, величина m/z эквивалентна массе нона. Если на выходе ионов из магнитного поля установить регистрирующее устройство, то частицы, различающиеся значениями m/z, будут давать раздельные сигналы. Интенсивность сигналов будет пропорциональна количеству частиц с данным значением m/z. Анализ ионов по величине m/z обычно производится при изменении напряженности магнитного поля; ионы постепенно фокусируются в щель коллектора, где регистрирующее устройство производит запись образующихся электрических импульсов. Запись спектра может быть произведена с помощью зеркального гальванометра на фотобумаге. Обычно запись производится при различной чувствительности гальванометра. Характерный вид получаемого при фотозаписи масс-спектра приводится на рисунке 4.1. Интенсивность сигналов определяется как их высота, выраженная в мм. Высота пика с максимальной интенсивностью принимается за 100 %, интенсивность остальных пиков пересчитывается пропорционально и выражается в процентах. Для пиков малой величины определяют относительную интенсивность путем пересчета по шкале большей чувствительности. Как правило, пики, интенсивность которых менее 3% (реже - 1 %), не принимаются во внимание.
Рисунок 4.1 – Масс-спектр этанола в фотозаписи (100°С, 30 эВ).
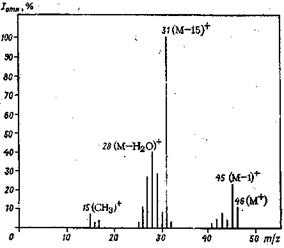
Масс-спектр принято изображать в виде набора отрезков прямых длина которых пропорциональна интенсивности пиков, выраженной в процентах, как это представлено на рисунке 4.2. В современных приборах обработка интенсивности электрических импульсов, соответствующих пикам с различающимися значениями m/z, производится с помощью компьютера, который выдает результаты измерений в виде двух отпечатанных колонок цифр: m/z и относительной интенсивности (интенсивность максимального пика принимается за 1000). Для этанола, например, масс-спектр которого представлен на рисинке 4.1 и 4.2, прибор с регистрирующим устройством такого типа выдаст следующую запись: m/z 15 28 31 45 46 I 92 402 1000 250 120
Рисунок 4.2 – Масс-спектр этанола (100°С, 30 эВ) в обработанном виде.
К такому же виду, естественно, легко может быть приведен и результат, полученный при фотозаписи, и, соответственно, наоборот. Однако спектр в виде рисунка более нагляден и удобен для расшифровки, особенно при малом опыте. Иногда масс-спектры приводятся в такой записи: указывают значения m/z, а рядом в скобках — относительную интенсивность в процентах, например: С2H5OH - масс-спектр (m/z): 15(9), 28(40), 31(100), 45(25), 46(12) С ростом m/z разница в отклонении магнитным полем частиц, различающихся на одну атомную единицу массы, уменьшается. В связи с этим важной характеристикой масс-спектрометров является их разрешающая способность (R), определяющая максимальную массу ионов, различающихся на одну атомную единицу массы, для которой прибор разделяет пики не менее чем на 90 %: R=M/ΔM где М — максимальная масса, для которой перекрывание пиков менее 10 %; ΔМ — одна атомная единица массы. Стандартные приборы имеют R ≈ 5000/1. Специальные приборы с двойной фокусировкой потока ионов с помощью электрического и магнитного поля позволяют достичь разрешения R ≈ 10000/1 - 100000/1. Такие приборы способны уловить разницу в молекулярной массе ионов до 0,0001. Высокие значения разрешающей способности не соответствуют реальным значениям молекулярной массы веществ, для которых может быть получен масс-спектр. Существенным ограничением является понижение летучести соединений с ростом молекулярной массы. Как правило, получение масс-спектров соединений с молекулярной массой более 500 затруднительно. Общий характер масс-спектра зависит от типа прибора и условий эксперимента, особенно от энергии ионизующих электронов. Для спектров смесей веществ с разной летучестью соотношение интенсивностей пиков отдельных компонентов может изменяться во времени соответственно с изменением их относительных концентраций в процессе напуска в ионизационную камеру; это соотношение зависит также от температуры. Масс-спектрометрия, особенно в сочетании с хроматографией, — один из наиболее информативных методов исследования структуры вещества. Для получения масс-спектра требуется ничтожно малое количество вещества — около 1 мкг.
МОЛЕКУЛЯРНЫЙ ИОН Максимальное значение m/z в спектре однородного вещества может иметь молекулярный нон (М+∙), масса которого равна молекулярной массе исследуемого соединения. Частица, первоначально образующаяся из молекулы под электронным ударом, является катион-радикалом, содержащим нечетное число электронов. Эта частица содержит или одну одноэлектронную связь или лишь один из электронов неподеленной пары при гетероатоме. Интенсивность пика молекулярного иона М+∙тем выше, чем этот ион стабильнее. В свою очередь, чем выгоднее образование осколочных ионов (см. разд. 5-3), т. е. чем они и образующиеся одновременно с ними нейтральные частицы устойчивее, тем ниже интенсивность пика М+∙. Относительная стабильность молекулярного иона связана со стабильностью соответствующей молекулы. Распад молекулярного иона осуществляется всегда значительно легче, так как он менее стабилен по сравнению с исходной молекулой. С ростом длины и особенно разветвленности цепи углеводородного радикала увеличивается число вероятных направлений распада молекулярного иона и соответственно уменьшается интенсивность его пика. Значения I ОТН варьируют в широких пределах от значительной (для ароматических соединений и диенов) до исчезающе малой (для спиртов и сильно разветвленных алканов). Так, в спектрах бензола и нафталина основным сигналом является М+∙, тогда как для высших алифатических спиртов пик молекулярного иона обнаружить не удается. По относительной величине пика молекулярного иона можно ориентировочно судить о классе соединений, к которому принадлежит исследуемое вещество. «Показатель ненасыщенности». По молекулярной массе М+∙, точнее, по 6рутто-формуле можно определить «показатель ненасыщенности молекулы по водороду, т. е. число пар атомов водорода, которые должны быть удалены из формулы соответствующего предельного ациклического соединения, чтобы получить формулу данного соединения. Этот показатель является суммой числа имеющихся в молекуле двойных связей и циклов, а также удвоенного числа тройных связей. «Азотное правило». Значение молекулярной массы М+∙ дает возможность определить в молекуле нечетное число атомов азота, так как в этом случае молекулярная масса соединения нечетная (например, СН3NH2 – m/z 31). Для молекул, имеющих четное число атомов азота, а также не содержащих этого элемента, значение молекулярной массы всегда четное. Изотопный состав. На структуру масс-спектра влияет изотопный состав элементов. Большинство элементов неоднородны по изотопному составу. В частности, углерод состоит из атомов 12С и 13С в соотношении 108 : 1. Следовательно, в масс-спектрах кроме основного пика М+∙ (только 12С появляется пик (М + 1) +∙ (содержащий 13С). С ростом числа С-атомов в молекуле интенсивность пика (М + 1)+∙ растет пропорционально увеличению вероятности появления атома 1ЗС. Так, если для соединения, содержащего один углеродный атом, соотношение [М] : [M + 1] = = 100: 1,12, то для вещества, имеющего 20 углеродных атомов, оно равно 100 : (1,12∙20)= 100 : 22,4. Соотношение [М] : [M + 1] позволяет для простых молекул ориентировочно оценить число атомов углерода в молекуле (увеличение интенсивности пика (М + 1)+∙ примерно на единицу с ростом углеводородной цепи на каждый С-атом). Пусть, например, иону М+∙ соответствует ион (М + 1)+∙, интенсивность которого меньше в 10 раз; тогда можно предположить, что исследуемое соединение содержит около 9—10 углеродных атомов. Из других элементов, изотопный состав которых существенно отражается на «рисунке» масс-спектра, следует назвать хлор и бром. Хлор состоит из двух изотопов 35Cl и 37Cl (3:1). Значит, пику молекулярного иона, содержащему один атом хлора, соответствует пик (М+2)+∙ втрое меньшей интенсивности. Такое же расщепление на два пика с соотношением интенсивностей 3 : 1 будет наблюдаться и для всех фрагментов, содержащих один атом хлора. Бром содержит два изотопа -79Br и 81Br – в равных количествах. Соответственно в соединениях, содержащих один атом - брома, молекулярный ион (а также бромсодержащие фрагменты) будет представлять собой два пика М+∙ и (М + 2)+∙ интенсивности. Характерное расщепление наблюдается фрагментов, содержащих два атома хлора [М] : [M+2] : [M+4] = 9,5 : 6 : 1 и для фрагментов с двумя атомами брома [M] : [M+2] : [M+4] = 1:2:1 Отсюда по характеру расщепления молекулярного нона может быть определено количество атомов хлора и брома в исследуемой молекуле. Ряд элементов (например, фтор, йод, фосфор) состоят только из одного изотопа. Для остальных обычных органических соединений элементов (кислород, азот) влияние изотопного их состава на масс-спектр незначительно, за исключением серы. Так, при наличии одного атома кислорода пик (М + 2)+∙ возрастает на ≈ 0,2 %; атом азота дает увеличение пика (М+ 1)+∙ на ≈ 0,4 %; атом серы дает рост пика (М + 1)+∙ на ≈ 0,8 % и пика (М + 2)+∙ на 4,5 %. Кроме того, атомные массы элементов (кроме 12С) имеют нецелочисленные значения: 1Н - 1,0078; 16О -15,9949; 14N - 14,0031 и т. д. Для одного и того же целого значения массового числа при различном элементном составе иона точная масса будет различной. Например, фрагмент с m/z / 28 может быть составлен из следующих наборов атомов: С2H4, СО и СН2N. Точные значения масс для перечисленных составов будут равны:
Если масс-спектрометр имеет высокое разрешение и способен зафиксировать приведенные различия в массах, то по точному значению массы иона может быть определена его брутто-формула. Анализ точного значения массовых чисел в масс-спектрах высокого разрешения производится автоматически с помощью компьютера. Результат выдается в виде колонки цифр; например, для приведенных ниже фрагментов
Масс-спектрометрия высокого разрешения благодаря возможности определения элементного состава как молекулярного иона, так и образующихся из него фрагментов в настоящее время получает все большее распространение.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-05-10; просмотров: 442. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |