
Студопедия КАТЕГОРИИ: АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция |
Характеристика щелочных металлов.К щелочным металлам относятся элементы первой группы, главной подгруппы: литий, натрий, калий, рубидий, цезий, франций. Свойства щелочных металлов.
Получение Т.к. щелочные металлы - это самые сильные восстановители, их можно восстановить из соединений только при электролизе расплавов солей: 2NaCl=2Na+Cl2 на катоде:Na++e=Na на аноде:2Cl--e=Cl2
СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ Щелочные металлы - самые сильные восстановители, их ионы не проявляют окислительных свойств. Гидроксиды(едкие щелочи) - твердые кристаллические вещества, типично ионные соединения, сильные основания. NaOH-едкий натр, каустическая сода Соли - типично ионные соединения, как правило-хорошо растворимы в воде, кроме некоторых солей лития. Образованные слабыми кислотами сильно гидролизуются. Na2CO3 10H2O - кристаллическая сода Na2CO3 - кальцинированная сода NaHCO3 - питьевая сода Качественные реакции: окрашивание пламени ионами Na+ - желтое 
3. Осуществите следующие превращения: Ва 1). 2Ba + O2 → 2BaO 2). BaO + H2SO4 → BaS04 + H2O 3). BaS04 + 2NaCl → ВаСl2 + Na2SO4
Билет-18 Кристаллические решетки. Кристаллические решётки веществ-это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки размещния частиц называют узлами кристаллической решётки. В зависимости от типа частиц, расположенных в узлах кристаллической решётки, ихарактера связи между ними различают 4 типа кристаллических решёток: ионные, атомные, молекулярные, металлические. Рассмотрим каждую из решёток в отдельности и поподробней.
Натрий. Соединения натрия. На́трий — элемент главной подгруппы первой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 11. Обозначается символом Na. Атомная масса – 23. Электронная конфигурация 1s22s22p63s1 p+=11 e-=11 n0=12 Натрий — серебристо-белый металл, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Кислородное соединение натрия – Na2O (Оксид натрия) Водородное соединение натрия – NaH (гидрид натрия) Получение натрия. Первым промышленным способом получения натрия была реакция восстановления карбоната натрия углем при нагревании: Na2CO3 + 2C → 2Na + 3CO Химические свойства натрия
СОЕДИНЕНИЯ ЩЕЛОЧНЫХ МЕТАЛЛОВ Щелочные металлы - самые сильные восстановители, их ионы не проявляют окислительных свойств. Гидроксиды(едкие щелочи) - твердые кристаллические вещества, типично ионные соединения, сильные основания. NaOH-едкий натр, каустическая сода Соли - типично ионные соединения, как правило-хорошо растворимы в воде, кроме некоторых солей лития. Образованные слабыми кислотами сильно гидролизуются. Na2CO3 10H2O - кристаллическая сода Na2CO3 - кальцинированная сода NaHCO3 - питьевая сода Качественные реакции: окрашивание пламени ионами Na+ - желтое
3. Осуществите следующие превращения: S 1). 2S + 3O2 → 2S03 2). S03 + H2O → H2S04 Билет-19 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2018-06-01; просмотров: 283. stydopedya.ru не претендует на авторское право материалов, которые вылажены, но предоставляет бесплатный доступ к ним. В случае нарушения авторского права или персональных данных напишите сюда... |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
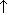
 BaO
BaO 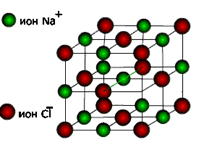 Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
Связи между ионами в кристалле очень прочные и устойчивые.Поэтому вещества с ионной решёткой обладают высокой твёрдостью и прочностью, тугоплавки и нелетучи.
 В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз-самый твёрдый природный материал.
В природе встречается немного веществ с атомной кристаллической решёткой. К ним относятся бор, кремний, германий, кварц, алмаз. Вещества с АКР имеют высокие температуры плавления, обладают повышенной твёрдостью. Алмаз-самый твёрдый природный материал.
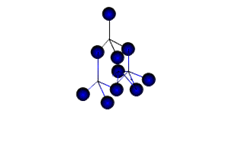
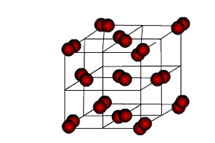 Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии
Вещества с МКР имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии
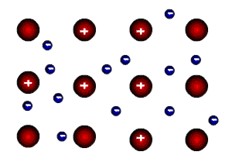 Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность
Для металлов характерны физические свойства: пластичность, ковкость, металлический блеск, высокая электро- и теплопроводность